
Una “buona” ricerca è tale se risponde a quesiti logici e meritevoli di risposta. Se uno studio possiede un disegno appropriato e viene realizzato correttamente giunge a risultati utili per ricercatori o clinici anche se gli esiti non sono quelli attesi. L’interesse è ovviamente maggiore per le ricerche che aprono nuove prospettive ma sarebbe doveroso e per nulla umiliante firmare un articolo che descrive un esito inferiore alle attese. Il fenomeno della mancata pubblicazione degli studi con esito sfavorevole viene definito “pubblicazione selettiva” e la conseguenza disastrosa sulla conoscenza è nota come publication bias: la diffusione della conoscenza ristretta solo a quanto selettivamente pubblicato e quindi una distorsione delle informazioni disponibili, orientate a una rappresentazione particolarmente (e falsamente) ottimistica rispetto all’efficacia e alla sicurezza degli interventi sanitari1. La mancata comunicazione di un risultato sfavorevole si traduce in una limitazione alla conoscenza (ignoranza) fino alla mistificazione della verità. Inoltre, si pongono le basi per un dispendio di risorse nella eventualità che altri ricercatori, ignari dei risultati negativi, intendano sviluppare studi nella stessa area di ricerca2. Senza dimenticare che la mancata pubblicazione di una ricerca clinica vanifica il sacrificio di liberalità compiuto dai soggetti - spesso ammalati - che hanno accettato di partecipare allo studio, magari consapevoli del fatto che potevano essere destinati ad un trattamento inefficace, ed avere anche degli effetti sfavorevoli dalla sperimentazione. Ma il publication bias si può anche manifestare attraverso una ridondanza di informazioni: succede infatti che risultati particolarmente favorevoli possano essere pubblicati più volte, utilizzando magari diverse riviste, così da riverberare l’impressione positiva che quei dati possono determinare3. Il risultato è sempre lo stesso: la distorsione informativa. Tornando ai risultati sfavorevoli, non è certo la vergogna che ha impedito a tanti risultati sfavorevoli di vedere la luce.
La preistoria Come per ogni preistoria che si rispetti, anche in quella della comunicazione scientifica esistono reperti importanti e chiaramente decodificabili, ma esistono molti (più?) altri “eventi” dei quali non esiste traccia se non pulviscolo di cometa... Una stima attendibile suggerisce che, fino ai primi anni ’90, una importante proporzione dei risultati della ricerca in area medica clinica non giungesse alla pubblicazione, alimentando un “limbo” informativo ovviamente mal definibile, ma di dimensioni ampiamente superiori all’inferno o al paradiso delle conoscenze scientifiche4. Per definizione è impossibile delineare con precisione le dimensioni del “nascosto”: una revisione retrospettiva del 1990, su 887 progetti di ricerca approvati tra il 1984 ed il 1987 dal Comitato Etico di Oxford, mostrava come solo il 52% degli studi fosse stato pubblicato ed è molto verosimile che nell’era della sperimentazione “selvaggia”, antecedente all’istituzione dei Comitati Etici, la proporzione degli studi iniziati e mai ultimati o ultimati e mai pubblicati fosse superiore. A questa dispersione (insabbiamento) di dati non contribuisce solo lo scarso interesse degli autori delle ricerche: una buona parte di responsabilità può anche essere attribuita ai comitati editoriali delle riviste scientifiche (soprattutto delle “grandi” testate), che possono avere conflitti di interesse nella pubblicazione di studi sponsorizzati con risultati favorevoli5.
Dalla scoperta della Bussola all’uso del Sestante Se nel disegno di uno studio la bussola dell’etica è la Dichiarazione di Helsinki, dove si afferma che:
Se nel disegno di uno studio la bussola dell’etica è la Dichiarazione di Helsinki, dove si afferma che:
• art. 8 - “il benessere dei soggetti coinvolti nella ricerca deve avere la precedenza su qualsiasi altro interesse”
• art. 22 - “il disegno di qualsiasi studio che coinvolge soggetti umani deve essere descritto e giustificato in un protocollo di ricerca”6,
serviva un qualcosa che rendesse pubblico e tracciabile il percorso degli studi clinici dopo l’approvazione da parte dei Comitati Etici. Nel 1997 Richard Smith dalle colonne del BMJ lanciò una invocazione alla registrazione degli studi clinici già realizzati che ancora non erano stati pubblicati7; oltre 100 riviste in tutto il mondo ri-echeggiarono l’invito che veniva formulato provocatoriamente sotto la forma di una “amnistia” volta a fare emergere una quantità di dati utili per la pratica clinica. Tristemente, nel corso dei 12 mesi successivi, solo 165 studi vennero registrati con quella procedura, una piccola goccia nell’oceano delle ricerche non pubblicate, e si consolidò la consapevolezza che la registrazione avrebbe dovuto aver luogo prospetticamente8. La pubblicazione in appositi registri dei protocolli degli studi è stata una misura molto importante. I due più importanti sono sotto l’egida dei National Institutes of Health negli Stati Uniti (clinicaltrials.gov) e dell’OMS (WHO International Clinical Trial Research Platform). Questi database liberamente consultabili rendono possibile - oltre alla valutazione dei protocolli originali della ricerca - la ricognizione sullo stato dello studio, l’individuazione di eventuali modifiche al protocollo originale, la verifica della avvenuta pubblicazione. Ma è proprio dalla consultazione di questi registri che emergono tutt’ora cambiamenti a posteriori negli esiti descritti (selezionando evidentemente i più favorevoli) nell’articolo pubblicato9, studi iniziati ma non dichiarati conclusi oltre il tempo stabilito dal protocollo, studi non pubblicati a distanza “sospetta” dalla conclusione dello studio10. È veramente disarmante notare come il report della pubblicazione dei risultati sia l’eccezione più che la regola: per esempio, impostando la ricerca con i termini “calcitonin” AND “bone” nel motore di ricerca del sito clinicaltrials.gov compaiono 41 studi completati dei quali solo 6 portano i risultati pubblicati. Per questo diviene sempre più pressante l’esigenza della pubblicazione dei risultati di tutti i trials, ribadita dalla stessa Dichiarazione di Helsinki (art. 35); encomiabile a questo proposito è lo sforzo di un movimento internazionale di ricercatori, che aderendo alla campagna denominata “All Trials” e attraverso ulteriori iniziative, stanno cercando di influenzare la stesura del nuovo Regolamento sui Clinical Trials attualmente in discussione presso il Parlamento Europeo, promuovendo la necessità di maggiore trasparenza11,12.
Anche la stessa EMA incoraggia il percorso alla trasparenza annunciando l’intenzione di rendere effettiva una politica di diffusione di dati anonimizzati relativi ai risultati degli studi clinici, nonostante le citazioni in giudizio da parte di due ditte farmaceutiche sulla base di una presunta sensibilità di questi dati dal punto di vista commerciale13. Non mancano poi gli assensi da parte dell’Industria a questo tipo di proposta, ma l’orizzonte non è davvero sgombro dalle nubi… Ad esempio, Glaxo Smith Kline - dopo la catastrofe di immagine derivante dalla condanna per avere falsificato dati, promosso impiego off label ed altre nefandezze con conseguente megamulta di 3 miliardi di dollari14- ha aderito alla campagna All Trials; tuttavia nei fatti ha ostacolato l’accesso ai dati in suo possesso nell’ambito di un progetto europeo di ricerca farmacologica (Innovative Medicines Initiative, finanziato dalla Commissione europea) che vede la collaborazione tra aziende farmaceutiche e strutture pubbliche, nonostante questi dati siano stati prodotti anche grazie agli input e all’essenziale supporto di centri pubblici15. Da parte sua, Roche ha dichiarato di essere pronta a rendere pubblici i risultati dei trials attualmente on file ed ha istituito un lucente database aperto al pubblico su tutti i trials da essa sponsorizzati a partire dal 2002. Nonostante questa asserita trasparenza restano aperte importanti questioni come quelle dell’impiego dell’oseltamivir nei soggetti sani, argomento di grande importanza per il quale la maggior parte dei risultati non risulta ancora pubblicata dopo anni dalla conclusione degli studi16. Pfizer ha annunciato la massima trasparenza attraverso la preannunciata attivazione di un database, disponibile a partire dal 2014: non saranno tuttavia inclusi i risultati delle sperimentazioni per indicazioni off label e questo rappresenta certamente una contraddizione in termini di reale buona volontà17. E dalle colonne di Nature leggiamo la perplessità di Richard Bergström, direttore generale della federazione europea delle industrie produttrici di medicinali (EFPIA), che dichiara che i rapporti contenenti i risultati degli studi non ancora pubblicati al momento non sono idonei per essere resi pubblici, e conferma azioni legali qualora l’EMA ne pretendesse la pubblicazione nelle condizioni attuali18.
Le rotte che portano lontano della verità L’elaborazione di un manoscritto per la pubblicazione vede normalmente gli Autori degli studi impegnati a presentare i risultati in modo da sottolinearne i risvolti positivi, mettendo in secondo piano (a volte omettendo) quelli meno favorevoli. Questo fa parte delle “naturali” strategie di chi tende ad esporre le componenti più gratificanti del proprio operato, ma questo comportamento diventa particolarmente grave quando non vengono comunicati risultati che possono riflettersi in un danno importante per le persone esposte ad un trattamento. Il percorso della pubblicazione dei risultati meno favorevoli incontra frequentemente ostacoli che ne ritardano la diffusione e spesso li seppellisce in archivi silenziosi dai quali - se possibile - non fuoriuscire mai più. Anche in quest’area di verità nascoste vengono in aiuto i documenti (veri e propri “cadaveri riesumati”) emersi dagli atti processuali relativi alle cause legali.
Coxib: scelte di tempi, infarti e morti nascoste Dalla lettura degli articoli pubblicati sull’efficacia e la sicurezza degli anti-COX 2 e, in particolare, dei documenti processuali delle cause legali contro l’azienda produttrice del rofecoxib, emergono dati sconcertanti che ritraggono in modo impietoso una continua azione di occultamento della verità tramite una comunicazione deliberatamente selettiva dei dati. In questi casi si è rivelato determinante il potere disporre dei protocolli originali degli studi desumibili dai registri per smascherare, anche se con fatica, la manovra di mistificazione della realtà. Dopo l’immissione in commercio, vennero pubblicati i risultati di due importanti studi (CLASS e VIGOR) realizzati per documentare la maggiore tollerabilità gastrointestinale di celecoxib e rofecoxib rispetto ai FANS tradizionali. La pubblicazione nel corso del 2000 dei risultati su riviste “top” (JAMA e New England Journal of Medicine) fu presentata con squilli di tromba, sdoganando ai più il concetto di una riconosciuta migliore tollerabilità dei Coxib rispetto ai FANS maggiormente in uso al momento. I risultati dello studio CLASS, pubblicati su JAMA, riportano tuttavia un dato rilevato a 6 mesi, quando la consultazione dei protocolli dei registri mostra che lo studio aveva durata di 12-15 mesi. Dalla revisione dei dati comunicati dall’FDA emerge come il beneficio a 12-15 mesi sia meno favorevole rispetto a quello rilevato a 6 mesi (vedi tabella).
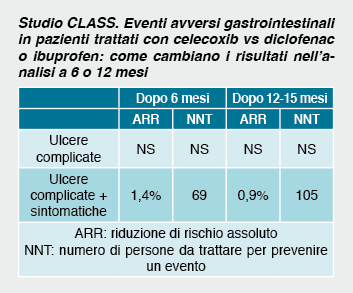 Decisamente peggiori tuttavia le distorsioni presenti nella valutazione del rofecoxib, ritirato dal commercio nel 2004 dopo che i dati sui danni cardiovascolari legati all’uso del farmaco vennero ulteriormente confermati dai risultati dello studio APPROVE19. Quattro anni prima era stato pubblicato lo studio VIGOR i cui autori, pur citandoli, evitarono di enfatizzare l’aumento di eventi avversi cardiovascolari riscontrato nei pazienti trattati col rofecoxib20.
Decisamente peggiori tuttavia le distorsioni presenti nella valutazione del rofecoxib, ritirato dal commercio nel 2004 dopo che i dati sui danni cardiovascolari legati all’uso del farmaco vennero ulteriormente confermati dai risultati dello studio APPROVE19. Quattro anni prima era stato pubblicato lo studio VIGOR i cui autori, pur citandoli, evitarono di enfatizzare l’aumento di eventi avversi cardiovascolari riscontrato nei pazienti trattati col rofecoxib20.
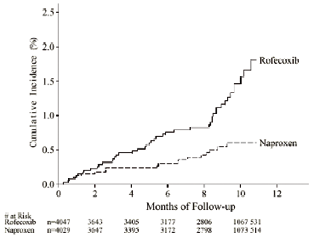
Il problema venne evidenziato un anno dopo dalla FDA: nonostante non si trattasse di incidenze in assoluto elevate (circa 2% in un anno), il rischio di andare incontro ad un evento cardiovascolare risultò almeno doppio nei pazienti in cura con rofecoxib rispetto ai pazienti che assumevano naproxene, incremento massimamente evidente dopo 8 mesi dall’inizio del trattamento (vedi figura)21.
FDA advisory Committee Briefing Document- February 8, 2001
Alla pubblicazione dello studio VIGOR che enfatizzava la riduzione degli eventi gastrointestinali con il rofecoxib rispetto al naprossene seguirono, dopo il ritiro del farmaco, due editoriali nei quali il “prestigioso” New England Journal of Medicine stigmatizzò la anomala presentazione dei dati nell’articolo originale (pubblicato tuttavia sulla stessa rivista) ed espresse la propria preoccupazione circa tali modalità fuorvianti di comunicazione22,23. Una meta-analisi dei dati disponibili avrebbe consentito già nel 2000 di identificare l’aumento del rischio vascolare che verrà definitivamente riconosciuto nello studio APPROVE con successivo ritiro del rofecoxib da parte dell’azienda produttrice24. Prendendo spunto da questo ritardo di comunicazione del rischio con esposizione di numerosi pazienti al farmaco e conseguente incremento del numero di infarti è stata aperta una causa legale contro Merck & co e dalla documentazione processuale sono emerse le tattiche utilizzate dalla ditta per mantenere segreti i risultati scomodi25,26 e per “neutralizzare” e screditare i medici che criticavano il farmaco sulla base dei dati conosciuti27. Due dei tre studi che avevano testato gli effetti del rofecoxib in pazienti con deficit cognitivi, nell’articolo pubblicato concludevano per una buona tollerabilità ed affrontavano in modo elusivo la mortalità riscontrata.
Quando nel dicembre 2001 l’FDA sollevò alcune perplessità sulla sicurezza del farmaco, l’azienda produttrice fornì solo dati limitati all’analisi on treatment (cioè sui pazienti che si erano auto-selezionati aderendo al protocollo di studio) che minimizzavano l’effetto, mentre erano disponibili anche le analisi statistiche intention to treat (cioè su tutti i pazienti arruolati nello studio), che mostravano un chiaro incremento del rischio di mortalità totale: 34 morti nei 1.067 pazienti del braccio rofecoxib vs 12 nei 1.078 pazienti randomizzati a placebo (HR 2,99: 95%CI 1,55-5,77)28. Senza l’acquisizione forzata delle “verità nascoste” sarebbe rimasta la buona impressione testimoniata dagli autori (8 su 11 dipendenti Merck).
Stronzio ranelato: vittima o carnefice? 
 Lo stronzio ranelato venne immesso in commercio in Europa il 21 settembre 2004 supportato da studi clinici che documentavano un aumento della massa ossea. La pubblicazione degli studi in fase III sulle fratture, SOTI e TROPOS, seguì di circa 2 anni la commercializzazione del farmaco; a tutt’oggi l’FDA non ha ancora ammesso il farmaco sul mercato americano. Al di là dell’inevitabile rilievo di una frettolosa autorizzazione basata esclusivamente su esiti surrogati privi di valore clinico, le stranezze di questo farmaco cominciano a dividere i clinici tra sostenitori e detrattori. I sostenitori si appellano all’originalità del farmaco, dotato di una azione duplice anti-riassorbimento e pro-ricalcificante, riportano la consistenza dei risultati (numerosità dei campioni, importanza degli esiti) e giudicano troppo severe le limitazioni poste dall’EMA per un farmaco “tutto sommato maneggevole e ben tollerato” che rappresenta una importante alternativa ai bisfosfonati e la cui efficacia è stata dimostrata fino a 10 anni di impiego28. Dall’altra parte, i detrattori puntano il dito sulla strategia spregiudicata di mistificazione operata dall’Azienda produttrice che - in un clima di assoluta NON-trasparenza - ha portato all’occultamento di eventi avversi accaduti durante le sperimentazioni ed alla magnificazione di una efficacia antifratturativa sulla quale cominciano ad affiorare dubbi legittimi. Innanzitutto giudicare favorevolmente un beneficio osseo basandosi sulla densitometria è inappropriato: avendo lo stronzio un peso atomico superiore a quello del calcio la densitometria rileverà una maggiore densità già solo per questo motivo senza che ciò significhi un reale miglioramento della qualità ossea.
Lo stronzio ranelato venne immesso in commercio in Europa il 21 settembre 2004 supportato da studi clinici che documentavano un aumento della massa ossea. La pubblicazione degli studi in fase III sulle fratture, SOTI e TROPOS, seguì di circa 2 anni la commercializzazione del farmaco; a tutt’oggi l’FDA non ha ancora ammesso il farmaco sul mercato americano. Al di là dell’inevitabile rilievo di una frettolosa autorizzazione basata esclusivamente su esiti surrogati privi di valore clinico, le stranezze di questo farmaco cominciano a dividere i clinici tra sostenitori e detrattori. I sostenitori si appellano all’originalità del farmaco, dotato di una azione duplice anti-riassorbimento e pro-ricalcificante, riportano la consistenza dei risultati (numerosità dei campioni, importanza degli esiti) e giudicano troppo severe le limitazioni poste dall’EMA per un farmaco “tutto sommato maneggevole e ben tollerato” che rappresenta una importante alternativa ai bisfosfonati e la cui efficacia è stata dimostrata fino a 10 anni di impiego28. Dall’altra parte, i detrattori puntano il dito sulla strategia spregiudicata di mistificazione operata dall’Azienda produttrice che - in un clima di assoluta NON-trasparenza - ha portato all’occultamento di eventi avversi accaduti durante le sperimentazioni ed alla magnificazione di una efficacia antifratturativa sulla quale cominciano ad affiorare dubbi legittimi. Innanzitutto giudicare favorevolmente un beneficio osseo basandosi sulla densitometria è inappropriato: avendo lo stronzio un peso atomico superiore a quello del calcio la densitometria rileverà una maggiore densità già solo per questo motivo senza che ciò significhi un reale miglioramento della qualità ossea.
Le ombre sugli studi SOTI29 e TROPOS30 cominciano già prima dell’inizio quando - a seguito di un unico reclutamento - le pazienti vennero inserite in uno o nell’altro studio in base ad una serie di caratteristiche cliniche che portarono ad una selezione molto importante con inevitabili riflessi sulla trasferibilità dei dati: di questo processo di reclutamento/selezione non vi è traccia nei due articoli originali ma solo nella presentazione del protocollo, comparsa su un supplemento di Osteoporosis International31. Come già siamo abituati a vedere i riassunti degli articoli sono roboanti e fuorvianti nelle conclusioni sino a doversi chiedere che cosa possa avere ridotto il livello di attenzione dei revisori per accettare proclami così entusiastici e falsi. Fatto sta che l’efficacia del ranelato è chiaramente documentata nella riduzione del rischio di fratture vertebrali in prevenzione secondaria, ma l’effetto di prevenzione sulle fratture di femore è molto meno documentato emergendo solo in una analisi post-hoc in sottogruppi a rischio particolarmente elevato. Ma - alla luce delle conclusioni degli stessi dati ri-analizzati dall’EMA - quello che più meraviglia è la assenza di attenzione per eventi avversi gravi che si è deciso evidentemente di non comunicare per non “sporcare” l’immagine dello stronzio, sperando che i dati reali non emergessero mai.
E invece i dati emergono: alimentata da un precedente scandalo di ordinaria mistificazione e intimidazione di esperti troppo critici (lo scandalo benfluorex, sollevato dal quotidiano francese Liberation)32 e dal riscontro di reazioni cutanee gravissime, emerse dalla farmacovigilanza33, l’attenzione sulla Azienda produttrice ha portato a una revisione da parte dell’EMA34, in particolare sull’aumento significativo del rischio di infarto del miocardio riscontrato nell’1,7% delle donne trattate (57 eventi) vs 1,1% delle donne randomizzate a placebo (36 eventi)35. A più riprese sono state comunicate nuove controindicazioni e restrizioni d’uso dello stronzio, la cui prescrivibilità è stata drasticamente limitata36. Sono passati quindi 9 anni dalla immissione in commercio dello stronzio ranelato alla limitazione del suo uso nei pazienti a rischio per cardiopatia, anni nei quali l’occultamento dei risultati ha consentito l’esposizione al farmaco di numerose pazienti a rischio. Considerando i milioni di confezioni di stronzio ranelato dispensate in Europa a soggetti a rischio, viene da chiedersi quando - come portato avanti dalle “vittime del Vioxx” negli USA - verrà avviato un procedimento legale da parte delle “vittime dello stronzio”. 
E….adesso ? Ad oggi, nonostante la registrazione dei protocolli e la pubblicazione dei risultati degli studi siano da tempo richieste dalla comunità scientifica e dalle più autorevoli riviste, e ora anche da norme che presto dovrebbero vedere la luce, nonostante la presenza dei comitati etici e i percorsi obbligati delle Good Clinical Practices, la stima della proporzione di esiti non pubblicati resta elevata, nascondendo alla conoscenza una parte rilevante dei dati di interesse clinico37. Al termine (inglorioso) di questa saga della mistificazione appare chiaro che i medici che hanno a cuore la cura dei propri assistiti non possono fare a meno di una valutazione attenta ed equilibrata di tutte le informazioni esistenti su efficacia e sicurezza di farmaci e di altri interventi sanitari. C’è bisogno che - come è accaduto per le reazioni cutanee da stronzio ranelato - i medici a contatto coi pazienti segnalino regolarmente le reazioni avverse, rompendo un muro di silenzio che può diventare reticenza, letale per la conoscenza. Ma c’è ancora più bisogno - allo stesso tempo - di conoscere “tutta” la verità senza che siano selezionati i risultati più incoraggianti o quelli che possono “muovere il mercato”: la disponibilità di tutte le informazioni può anche aiutare a restituire un ruolo all’esperienza personale del singolo medico, necessaria per valutare, senza forzature e bias, l’applicabilità delle conoscenze disponibili nel contesto della pratica clinica quotidiana.
Bibliografia 1. Dickersin K. et al. Recognizing, investigating and dealing with incomplete and biased reporting of clinical research: from Francis Bacon to the WHO. J R Soc Med 2011; 104:532-8.
2. Chalmers R Underreporting research is scientific misconduct. JAMA 1990; 263:1405-08.
3. Von Elm E et al. Different Patterns of Duplicate Publication: An Analysis of Articles Used in Systematic Reviews. JAMA 2004; 291:974-80.
4. Easterbrook PJ et al. Publication bias in clinical research. Lancet 1991; 337:867-72.
5. Smith R (2005) Medical Journals Are an Extension of the Marketing Arm of Pharmaceutical Companies. PLoS Med 2(5): e138. doi:10.1371/journal.pmed.0020138.
6. WMA Declaration of Helsinki - Ethical Principles for Medical Research Involving Human Subjects. Disponibile su: http://www.wma.net/en/30publications/10policies/b3/ (ultimo accesso: 8 gennaio 2014).
7. Smith R. An amnesty for unpublished trials. BMJ 1997; 315:622.
8. Roberts I. An amnesty for unpublished trials. One year on, many trials are unregistered and the amnesty remains open. BMJ 1998; 317:763-4.
9. Kirkham JJ et al. The impact of outcome reporting bias in randomised controlled trials on a cohort of systematic reviews. BMJ 2010; 340:c365.doi: 10.1136/bmj.c365.
10. Song F et al. Dissemination and publication of research findings: an updated review of related biases. Health Tecnology Assessment 2010; vol.14: n.8 http://www.hta.ac.uk/fullmono/mon1408.pdf.
11. http://www.altrials.net.
12. Formoso G, Nonino F, Maestri E, Magrini N. Ricerca clinica nella UE e pubblicazione dei dati: maggiore trasparenza? Informazioni sui Farmaci 2013; 2:43-46.
13. Groves T et al. The European Medicines Agency’s plans for sharing data from clinical trials. BMJ 2013; 346:f2961.
14. Roehr B. Glaxo Smith Kline is fined record $ 3 bn in US. BMJ 2012; 345:e4568.
15. Garattini S. et al. A failed attempt at collaboration. BMJ 2013; 347:f5354.
16. Godlee F. Open letter to Roche about oseltamivir trial data. BMJ 2012; 345:e7305.
17. Kmietowicz Z Pfizer’s open data policy should include trials of off label uses, say critics. BMJ 2013; 347:f7327.
18. Cressey D. Secrets of trial data revealed. Records of side effects seen in clinical tests are missing from publicly available documents. Nature 2013; 502:154-155.
19. Bresalier RS at al.Cardiovascular Events Associated with Rofecoxib in a Colorectal Adenoma Chemoprevention Trial. N Engl J Med 2005; 352:1092-1102.
20. Bombardier C et al. for the VIGOR Study Group. Comparison of Upper Gastrointestinal Toxicity of Rofecoxib and Naproxen in Patients with Rheumatoid Arthritis. N Engl J Med 2000; 343:1520-1528.
21. FDA advisory Committee Briefing Document; February 8, 2001. Disponibile su http://www.fda.gov/ohrms/dockets/ac/01/briefing/3677b2_03_med.doc (ultimo accesso: 8 gennaio 2014).
22. Curfman GD et al. Expression of Concern: Bombardier et al., “Comparison of Upper Gastrointestinal Toxicity of Rofecoxib and Naproxen in Patients with Rheumatoid Arthritis”. N Engl J Med 2005; 353:2813-2814.
23. Curfman GD et al. Expression of Concern Reaffirmed. N Engl J Med 2006; 354:1193.
24. Jüni P et al. Risk of cardiovascular events and rofecoxib: cumulative meta-analysis. Lancet 2004; 364:2021-9.
25. Psaty BM et al. Reporting Mortality Findings in Trials of Rofecoxib for Alzheimer Disease or Cognitive Impairment. JAMA 2008; 299:1813-17.
26. Angell M. Industry-Sponsored Clinical Research. A Broken System. JAMA 2008; 300:1069-71.
27. Moynihan R. Court hears how drug giant Merck tried to “neutralise” and “discredit” doctors critical of Vioxx. BMJ 2009; 338:b1432.
28. Reginster JY et al. Mantenance of antifracture efficacy over 10 years with strontium ranelate in postmenopausal osteoporosis. Osteoporos Int 2012; 23:1115-1122.
29. Reginster JY et al. Strontium ranelate reduces the risk of non vertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) Study. J Clin Endocrinol Metab 2005; 90:2816-2822.
30. Meunier P et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350:459-468.
31. P.J. Meunier Æ J.Y. Reginster Design and methodology of the phase 3 trials for the clinical development of strontium ranelate in the treatment of women with postmenopausal osteoporosis. Osteoporos Int 2003; 14(Suppl 3):S66-S76.
32. Favereau E et al. La technique de l’intimidation. Liberation, 23.12.2010.
33. Cacoub P et al. Drug rash with eosinophilia and systemic symptoms (DRESS) in patients receiving strontium ranelate. Osteoporos Int 2013; 24:1751-7.
34. http://www.ema.europa.eu/docs/en_GB/document_Library/Referrals_document/Protelos_-and_Osseor/Procedure_started/WC500143499.pdf.
35. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Product_Information/human/000560/WC500045525.pdf.
36. http://www.agenziafarmaco.gov.it/sites/default/files/strontium_ranelate_aifa.pdf.
37. Wieseler B et al. Completeness of Reporting of Patient-Relevant Clinical Trial Outcomes: Comparison of Unpublished Clinical Study Reports with Publicly Available Data PLOS Medicine PLoS Medicine 2013; 10(10) e1001526.
Data di Redazione 4/2014