Sei qui: Home Page / Area farmacista / Biblioteca / Informazioni sui farmaci / Consulta la Rivista / Anno 2015 / Numero 1 del 2015 / Insulina Degludec

Indicazioni registrate. Trattamento del diabete mellito in adulti.
Dosaggio. Il dosaggio di degludec deve essere determinato sulla base delle necessità individuali dei pazienti.
Classe A
Con Piano Terapeutico (da redigere a cura delle strutture diabetologiche da parte di internisti, endocrinologi o geriatri)
Soggetta a monitoraggio addizionale
Proprietà farmacologiche
L’insulina degludec è un’insulina basale ultra-lenta il cui nome deriva dalla eliminazione dalla molecola di insulina umana del residuo di treonina acido in posizione B30 (DesB30), dall’aggiunta di acido glutamico (Glu) che funge da spaziatore per il legame con un acido esadecandiolico (Dec) con il gruppo ε-amino di lisina in posizione B291. Tale struttura permette di formare, dopo l’iniezione per via sottocutanea, multi-esameri stabili e solubili che formano un deposito nel tessuto sottocutaneo. La graduale separazione di monomeri dai multi-esameri porta ad un lento e continuo assorbimento dell’insulina degludec dal sottocute nella circolazione, che induce un effetto ipoglicemizzante uniforme e stabile.
Grazie al suo profilo farmacocinetico e farmacodinamico l’insulina degludec ha una durata d’azione maggiore delle altre insuline attualmente disponibili ed una distribuzione dell’effetto in modo uniforme nelle prime e nelle seconde 12 ore del giorno. Caratteristica di tale insulina è la necessità del raggiungimento dello steady-state che si ottiene dopo 2-3 giorni dalla prima somministrazione. L’insulina degludec si lega specificamente al recettore dell’insulina umana e induce gli stessi effetti farmacologici dell’insulina umana.
Efficacia clinica
L’efficacia dell’insulina degludec è stata valutata nell’ampio programma degli studi BEGIN che includono 9 studi della durata di 26-52 settimane, tre dei quali condotti nei pazienti con diabete di tipo 1 e sei nel tipo 2. Tutti gli studi clinici che hanno testato l’efficacia e la sicurezza dell’insulina degludec sono trial randomizzati, in aperto, con disegno treat-to-target in cui l’insulina viene confrontata con farmaco attivo. Il principio treat-to-target prevede che il dosaggio dell’insulina degludec e dell’insulina di confronto sia aggiustato in ciascun paziente in modo da raggiungere lo stesso target glicemico. È stato pertanto utilizzato un disegno di non-inferiorità. Gli obiettivi principali degli studi erano i livelli di emoglobina glicosilata (HbA1c) raggiunti al termine del trattamento e i tassi di ipoglicemia. Le ipoglicemie confermate, definite come glicemie al di sotto di 3.1 mmol/l [56 mg/dL] (o necessità del paziente di assistenza da parte di una terza persona) sono infatti state incluse negli studi come end-point di efficacia. Tuttavia, i dati sono stati anche raccolti in base al cut-off di 3.9 mmol/l [70 mg/dL]. L’ipoglicemia notturna confermata era definita come episodi tra la mezzanotte e le 6 del mattino.
Gli studi possono essere distinti in base alla popolazione analizzata:
Pazienti con diabete di tipo 1:
Pazienti con diabete di tipo 2 che non sono mai stati in terapia insulinica (insulin naїve):
Pazienti con diabete di tipo 2 in trattamento insulinico:
Controllo metabolico
In tutti gli studi l’insulina degludec ha dimostrato la sua non-inferiorità in termini di riduzione dell’emoglobina glicosilata rispetto all’insulina glargine nella maggior parte dei trial o rispetto ad altri farmaci di confronto. Nei pazienti con diabete di tipo 1 si è osservata una riduzione dei livelli di HbA1c dello 0.4-0.7 %. L’insulina degludec si associava anche ad una maggiore riduzione della glicemia a digiuno rispetto all’insulina glargine. Nello studio di flessibilità3 in cui i pazienti erano randomizzati ad assumere insulina degludec secondo uno schema terapeutico che prevede un intervallo di 8-40 ore tra due assunzioni consecutive, insulina degludec da assumersi sempre alla stessa ora serale ed insulina glargine, l’insulina degludec somministrata in modo flessibile è risultata non inferiore alla glargine in termini di controllo metabolico. I livelli di HbA1c al termine del trattamento non erano diversi da quelli dei pazienti che assumevano insulina degludec alla sera. Al termine dello studio i livelli di glicemia a digiuno erano significativamente inferiori nei pazienti trattati con degludec in modo flessibile rispetto a quelli trattati con degludec in modo fisso glargine (-1.73 vs. -0.61 mmol/L [-31,14 vs. -10,98 mg/dL]; p = 0.005).
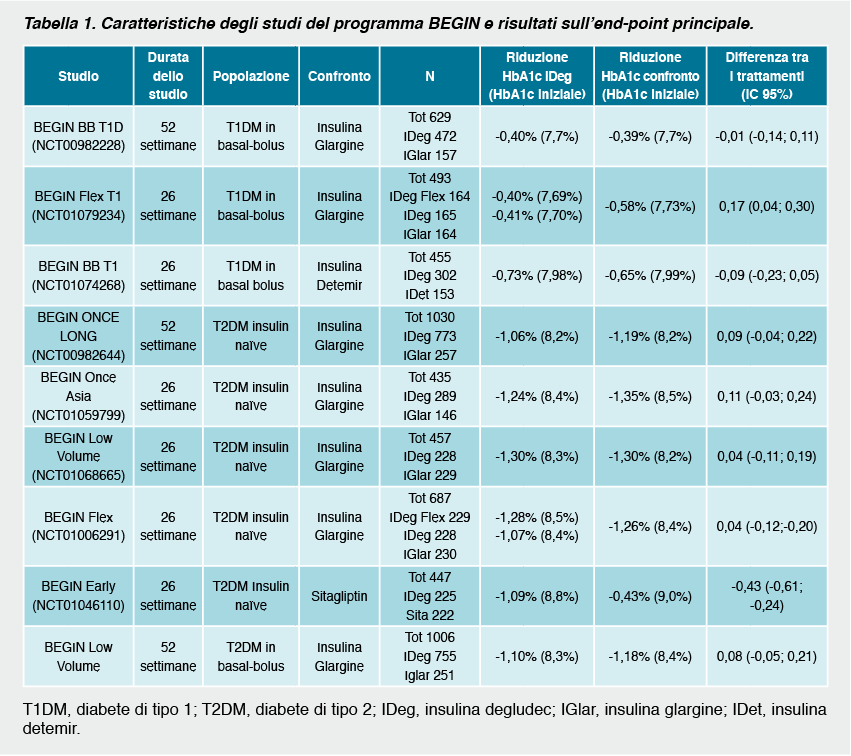
Nei soggetti con diabete di tipo 2, usato da solo o in combinazione con farmaci ipoglicemizzanti orali l’insulina degludec ha determinato una riduzione dell’HbA1c di circa 1,1-1,3% confrontata con la riduzione pari a 1,2-1,4% ottenuta con le altre insuline di confronto. In termini di glicemia a digiuno l’insulina degludec ha prodotto una maggiore riduzione rispetto alla glargine negli studi BEGIN Once Long7 e BEGIN Low Volume6 e nessuna differenza invece nel trial BEGIN BB T2D9. L’insulina degludec è risultata più efficace rispetto alla sitagliptina nella riduzione dell’HbA1c, della glicemia a digiuno (-3.22 vs. -1.39 mmol/L [-47 vs. 25 mg/dL]; p<0.0001) e una percentuale maggiore di soggetti ha raggiunto un target di HbA1c ≥ 7% (41 vs. 28 %; p = 0.034). Sono stati recentemente pubblicati i dati relativi all’estensione dello studio BEGIN Once Long della durata di 2 anni10 in cui soggetti in trattamento con insulina degludec in combinazione con metformina erano randomizzati ad aggiungere liraglutide o insulina aspart. L’aggiunta di liraglutide ha portato ad una maggiore e significativa riduzione statistica di HbA1c (-0,74% per liraglutide contro -0,40% per i farmaci di confronto). Il 50% dei pazienti trattati con insulina degludec in aggiunta a liraglutide ha raggiunto un target di HbA1c < 7,0%, rispetto al 7% dei pazienti che avevano aggiunto insulina aspart.
Ipoglicemie
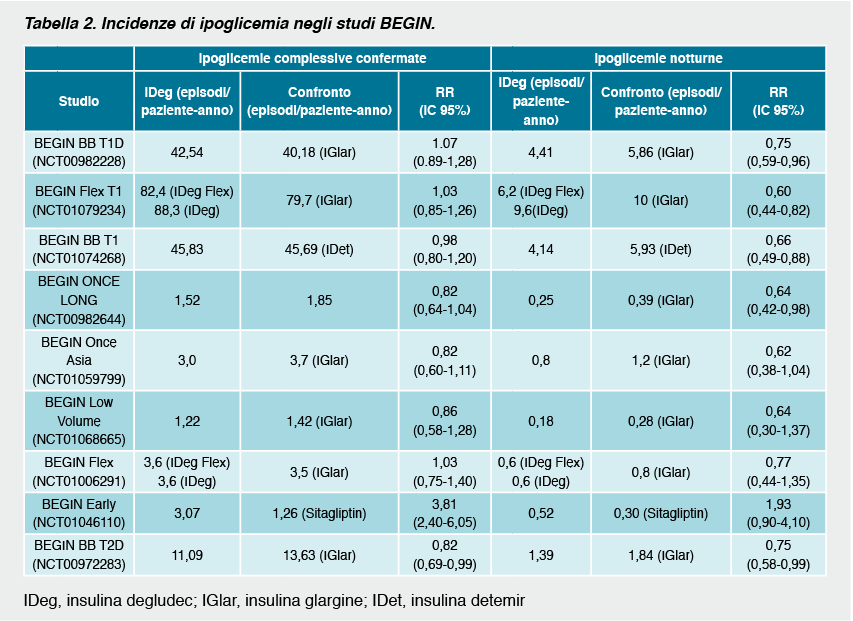
In generale, il tasso di ipoglicemie notturne è risultato significativamente più basso nei pazienti con diabete di tipo 1 trattati con degludec rispetto ai soggetti trattati con glargine. Per quanto riguarda gli episodi di ipoglicemia confermata i tassi verificatisi nei pazienti in trattamento con degludec rispetto alle insuline basali di confronto non erano statisticamente diversi. Il 10-13% dei pazienti con diabete di tipo 1 ha riportato episodi di ipoglicemia severa durante il trattamento. Circa il 90% dei soggetti ha invece avuto almeno un episodio di ipoglicemia confermata. Il tasso di abbandono dello studio dovuto ad eventi avversi era più frequente nel gruppo randomizzato a degludec rispetto alle altre insuline. Ciò era probabilmente dovuto al fatto che, essendo studi in aperto, ci fosse maggiore attenzione verso la nuova insulina e che la maggior parte dei soggetti con diabete di tipo 1 randomizzati al braccio di controllo mantenevano la loro precedente insulina. Nel diabete di tipo 2 non emergono differenze significative negli studi in cui la degludec era assunta in concomitanza con altri ipoglicemizzanti orali, mentre nei soggetti in trattamento insulinico9 si evidenziava una riduzione significativa degli episodi di ipoglicemia complessiva e notturna. Se paragonata a sitagliptin la degludec determinava una maggiore incidenza di ipoglicemie complessive, ma non di quelle notturne. L’effetto dell’insulina degludec sul rischio ipoglicemico è stato ulteriormente indagato in una meta-analisi di 7 trial clinici in cui la degludec è stata confrontata all’insulina glargine sia nel diabete di tipo 1 che nel tipo 21. Complessivamente, la meta-analisi ha evidenziato una riduzione del rischio di ipoglicemia nei pazienti in trattamento con degludec rispetto a glargine sia per quanto riguarda le ipoglicemie complessive (RR=0.91, IC 95% 0,83-0,99) sia le ipoglicemie notturne (RR=0.74, IC 95% 0,65-0,85). In termini di ipoglicemie severe non si evidenziavano al contrario differenze significative (RR=0.98, IC 95% 0.66-1.45). Nella popolazione con diabete di tipo 1 non si evidenziavano tuttavia differenze statisticamente significative tra le due insuline (RR=1.10, IC 95% 0.96-1.26, per le ipoglicemie complessive; RR=0.83, IC 95% 0.69-1.00, per le ipoglicemie notturne e RR=1.12, IC 95% 0.68-1.86 per gli episodi severi). Tra i soggetti con diabete di tipo 2 insulin naïve si evidenziava un ridotto tasso di episodi ipoglicemici rispetto alla glargine (RR=0.83, IC 95% 0.70-0.98 per le ipoglicemie complessive; RR=0.64, IC 95% 0.48-0.86 per le ipoglicemie notturne; RR=0.14 IC 95% 0.03-0.70 per le ipoglicemie severe). Complessivamente nei soggetti con diabete di tipo 2 l’insulina degludec determinava una minore incidenza di episodi di ipoglicemie confermate ed ipoglicemie notturne rispetto alla glargine (RR=0.83, IC 95% 0.74-0.94; RR=0.68, IC 95% 0.57-0.82, rispettivamente).
Effetti indesiderati
Rinofaringite, infezioni del tratto respiratorio, cefalea e diarrea sono risultati essere gli effetti collaterali più frequenti con l’utilizzo di insulina degludec. Le reazioni nel sito di iniezione sono risultate lievi e moderate e il tasso di lipodistrofia è stato basso. Durante i trial non sono emerse differenze nel tasso di tumori maligni verificatisi. La sicurezza cardiovascolare è stata valutata nell’ambito di una meta-analisi basandosi sui dati di quasi 9000 soggetti (di cui oltre 5000 trattati con insulina degludec). Complessivamente, il tasso di eventi cardiovascolari maggiori non è risultato statisticamente diverso da quello dei farmaci di confronto (1.48 eventi per 100 persone-anno 1.44 eventi per 100 persone-anno, per l’insulina degludec ed i confronti, rispettivamente; HR=1.097; IC 95% 0.681-1.768). Al contrario dell’EMA, la FDA non ha ancora approvato la commercializzazione del farmaco negli Stati Uniti ed ha richiesto ulteriori dati di sicurezza cardiovascolare. La richiesta si basa su un presunto eccesso di rischio cardiovascolare evidenziato con l’uso di degludec in una ulteriore meta-analisi (HR=1,67; IC 95% 1,01-2,75) che utilizzava una diversa definizione di end-point escludendo le angine instabili12. È pertanto attualmente in corso il trial DEVOTE (A Trial Comparing Cardiovascular Safety of Insulin Degludec Versus Insulin Glargine in Subjects With Type 2 Diabetes at High Risk of Cardiovascular Events) per la valutazione della sicurezza cardiovascolare dell’insulina degludec verso insulina glargine in soggetti con diabete di tipo 2. Lo studio, che ha reclutato oltre 7.500 pazienti, è in doppio cieco e l’end-point principale è costituito dalla mortalità cardiovascolare, infarto del miocardio ed ictus. Il trial dovrebbe essere completato nella seconda metà del 2016, tuttavia la FDA ha recentemente accettato di rivalutare la documentazione del farmaco alla luce dei risultati dell’analisi ad interim dello studio, dati che sono stati resi noti solo ad un piccolo team, allo scopo di preservare l’integrità del trial ancora in corso.
Avvertenze
Le proprietà farmacocinetiche della degludec che ne determinano la lunga durata d’azione vengono preservate in soggetti con alterazioni renali o epatiche lievi, moderate o gravi. In caso di compromissione renale non è necessario un aggiustamento del dosaggio; è opportuno intensificare il monitoraggio della glicemia ed aggiustare la dose dell’insulina su base individuale. L’EMA ha emesso parere positivo anche per l’utilizzo dell’insulina degludec nei bambini ed adolescenti affetti da diabete di età compresa tra 1 e 17 anni. L’approvazione si basa sui dati positivi dello studio BEGIN YOUNG 111, il primo trial che ha valutato la sicurezza a lungo termine di questa insulina in bambini con diabete di tipo 1. Lo studio, della durata di 52 settimane, ha valutato la sicurezza e l’efficacia di degludec in soggetti con età compresa tra 1 e 17 anni, dimostrando la non inferiorità rispetto all’insulina detemir in termini di controllo metabolico. I tassi di ipoglicemia sono risultati simili così come l’incidenza di altri eventi avversi. Una meta-analisi condotta specificamente nei soggetti anziani (età ≥ 65 anni) non ha evidenziato differenze con la popolazione generale, e ha confermato una minore incidenza di episodi di ipoglicemia soprattutto notturni, molto frequenti in questa categoria di pazienti, rispetto alla glargine. Può pertanto rappresentare una valida opzione terapeutica in questa popolazione anche se è comunque consigliato una intensificazione del monitoraggio della glicemia ed un eventuale aggiustamento della dose dell’insulina.
Modalità di somministrazione
L’insulina degludec è in forma di soluzione iniettabile in penna pre-riempita da somministrare per via sottocutanea una volta al giorno, preferibilmente alla stessa ora ogni giorno. Nel caso ciò non fosse possibile, tale insulina permette una maggiore flessibilità di somministrazione anche se deve essere sempre garantito un intervallo minimo di 8 ore tra le due somministrazioni. Pur non essendo stati condotti per essere poi applicati alla pratica clinica, gli studi BEGIN Flex, hanno infatti dimostrato che l’insulina degludec può avere uno schema di dosaggio più flessibile, senza alcun impatto né sul controllo metabolico, né sul rischio ipoglicemico. In pazienti con diabete mellito di tipo 2, l’insulina degludec può essere somministrato da sola o in qualsiasi combinazione con medicinali antidiabetici orali, agonisti del recettore del GLP-1 e insulina in bolo. Nel diabete mellito di tipo 1, l’insulina degludec deve essere combinata a un’insulina ad azione breve/rapida per coprire il fabbisogno insulinico prandiale.
Costi
Il costo di un mese di terapia con insulina degludec dipende dalla dose quotidiana che può essere anche molto diversa da paziente a paziente. Tuttavia, considerando che una unità (U) di insulina degludec corrisponde a 1 unità internazionale (UI) di insulina umana e a 1 unità di insulina glargine o a 1 unità di insulina detemir, dal confronto delle rispettive confezioni risulta che:
il costo di Tresiba è di € 137,08 il costo di Lantus Solostar e di Levemir Flex è di € 79,85
Bibliografia
1.http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002498/WC500139010.pdf.
2. Heller S. et al. on behalf of the BEGIN Basal-Bolus Type 1 Trial Investigators. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 1 diabetes (BEGIN Basal-Bolus Type 1): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012 Apr 21; 379(9825):1489-97.
3. Mathieu C. et al. Efficacy and safety of insulin degludec in a flexible dosing regimen vs insulin glargine in patients with type 1 diabetes (BEGIN: Flex T1): a 26-week randomized, treat-to-target trial with a 26-week extension. J Clin Endocrinol Metab 2013; 98(3):1154–62.
4. Zinman B. et al. NN1250-3579 (BEGIN Once Long) Trial Investigators. Insulin degludec versus insulin glargine in insulin-naive patients with type 2 diabetes: a 1-year, randomized, treat-to-target trial (BEGIN Once Long). Diabetes Care 2012 Dec; 35(12):2464-71.
5. Onishi Y. et al. Insulin degludec compared with insulin glargine in insulin-naïve patients with type 2 diabetes: A 26-week, randomized, controlled, Pan-Asian, treat-to-target trial. J Diabetes Investig 2013 Nov 27; 4(6):605-12.
6. Gough SC. et al. Low-volume insulin degludec 200 units/ml once daily improves glycemic control similarly to insulin glargine with a low risk of hypoglycemia in insulin-naive patients with type 2 diabetes: a 26-week, randomized, controlled, multinational, treat-to-target trial: the BEGIN LOW VOLUME trial. Diabetes Care 2013 Sep; 36(9):2536-42.
7. Meneghini L. et al. NN1250-3668 (BEGIN FLEX) Trial Investigators. The efficacy and safety of insulin degludec given in variable once-daily dosing intervals compared with insulin glargine and insulin degludec dosed at the same time daily: a 26-week, randomized, open-label, parallel-group, treat-to-target trial in individuals with type 2 diabetes. Diabetes Care 2013 Apr; 36(4):858-64.
8. Philis-Tsimikas A. et al. Effect of insulin degludec versus sitagliptin in patients with type 2 diabetes uncontrolled on oral antidiabetic agents. Diabetes Obes Metab 2013 Aug; 15(8):760-6.
9. Garber AJ et al. NN1250-3582 (BEGIN BB T2D) Trial Investigators. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012 Apr 21; 379(9825):1498-507.
10. Mathieu C. et al. BEGIN: VICTOZA ADD-ON (NN1250-3948) study group. A comparison of adding liraglutide versus a single daily dose of insulin aspart to insulin degludec in subjects with type 2 diabetes (BEGIN: VICTOZA ADD-ON). Diabetes Obes Metab 2014 Jul; 16(7):636-44.
11. Thalange N. et al. Long-term efficacy and safety of insulin degludec in combination with bolus insulin aspart in children and adolescents with type 1 diabetes. Poster presented at the 50th Annual Meeting of the European Association for the Study of Diabetes (EASD), Vienna,
Austria, 15-19 September 2014.
12.http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/UCM330923.pdf.
Data di Redazione 03/2015
Degludec è una nuova insulina basale a lunga durata d’azione che si affianca a quelle già disponibili, glargine e detemir, rispetto alle quali i dati del programma di sviluppo clinico hanno evidenziato, sia nel diabete di tipo 1 sia nel diabete di tipo 2, la non-inferiorità in termini di controllo metabolico e la sostanziale sovrapponibilità per quanto riuguarda il profilo di sicurezza. Sembra tuttavia ridurre l’incidenza di episodi ipoglicemici soprattutto notturni, verosimilmente per la minore variabilità glicemica, e può avere uno schema di dosaggio più flessibile, il che potrebbe rappresentare un vantaggio per alcuni pazienti con stili di vita imprevedibili. Questi possibili vantaggi tuttavia vanno valutati rispetto alla sicurezza a lungo termine, ancora non completamente nota soprattutto per quanto riguarda gli eventi cardiovascolari e, al momento non sembrano giustificare il costo molto più alto rispetto alle altre insuline basali.