
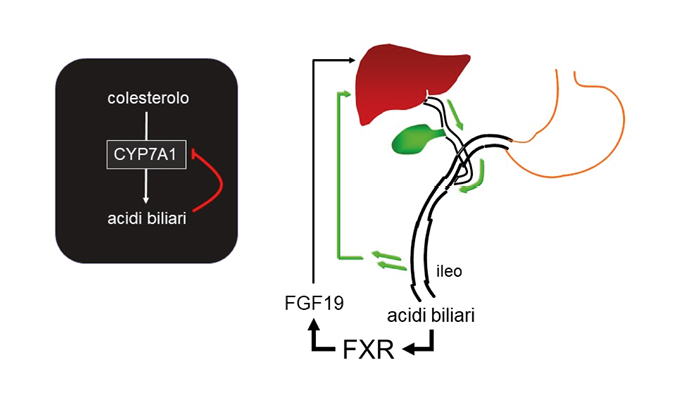
 mento di patologie correlate all’epatocarcinoma come l’epatopatia non alcolica (NAFLD) e la steato-epatite non alcolica (NASH). Studi preclinici hanno anche dimostrato che l’OCA è in grado di regolare il metabolismo lipidico e glucidico e di inibire la risposta infiammatoria, determinando anche una riduzione della fibrosi epatica e prevenendo l’insorgenza della cirrosi e della infiammazione intestinale12. Visti i risultati sul ruolo di OCA ed FXR nel metabolismo lipidico e nella fibrosi epatica, oltre agli studi clinici sulla colangite biliare primitiva, sono stati intrapresi studi clinici su pazienti con NAFLD e NASH. Nel primo studio clinico di fase II sono stati arruolati pazienti con diabete di tipo 2 e NAFLD ai quali è stato somministrato placebo o OCA alla concentrazione di 25 mg e 50 mg per 6 settimane13. Questo studio ha dimostrato che il farmaco ha effetti benefici sull’uptake di glucosio epatico e periferico grazie ad un miglioramento dell’insulino-sensibilità. Tuttavia, a causa della breve durata del trattamento non sono stati valutati parametri clinici importanti come l’emoglobina glicata. Inoltre, è stata osservata una significativa perdita di peso dose-dipendente nei pazienti trattati con OCA ed un miglioramento della fibrosi epatica, dimostrando una buona sicurezza e tollerabilità del farmaco13. In seguito ai risultati ottenuti, è stato poi effettuato lo studio FXR Ligand NASH Treatment (FLINT) in cui sono stati arruolati circa 280 pazienti americani affetti da NASH somministrando placebo o 25 mg di OCA per 72 settimane14. I pazienti trattati con OCA hanno mostrato un miglioramento epatico dal punto di vista istologico, caratterizzato da una riduzione della fibrosi, della steatosi e dell’infiammazione lobulare. Inoltre, il trattamento con OCA è stato associato a riduzione del peso corporeo e della pressione sanguigna. Va sottolineato però che il 23% dei pazienti trattati con il farmaco ha manifestato prurito14 e che una certa cautela va mantenuta sugli effetti a carico del metabolismo del colesterolo per l’eventuale aumento della concentrazione dello stesso nel siero dei pazienti. Quindi, lo studio FLINT ha dimostrato che l’OCA è in grado di migliorare le caratteristiche istologiche dei pazienti con NASH ma ulteriori studi sono necessari al fine di chiarire la sicurezza a lungo termine di questo farmaco. Sono peraltro in studio una serie di nuovi composti in grado di attivare FXR e molti di essi hanno struttura chimica differente da quella degli acidi biliari e sono già in fase sperimentale sull’uomo. Pertanto numerosi studi clinici sono in corso sull’uomo sia con composti in grado di attivare FXR, rilevanti in patologie epatiche come colestasi e NASH, sia con analoghi dell’ormone FGF19 che mantengono l’attività prometabolica di questa enterochina ma sono privi dell’attività protumorale.
mento di patologie correlate all’epatocarcinoma come l’epatopatia non alcolica (NAFLD) e la steato-epatite non alcolica (NASH). Studi preclinici hanno anche dimostrato che l’OCA è in grado di regolare il metabolismo lipidico e glucidico e di inibire la risposta infiammatoria, determinando anche una riduzione della fibrosi epatica e prevenendo l’insorgenza della cirrosi e della infiammazione intestinale12. Visti i risultati sul ruolo di OCA ed FXR nel metabolismo lipidico e nella fibrosi epatica, oltre agli studi clinici sulla colangite biliare primitiva, sono stati intrapresi studi clinici su pazienti con NAFLD e NASH. Nel primo studio clinico di fase II sono stati arruolati pazienti con diabete di tipo 2 e NAFLD ai quali è stato somministrato placebo o OCA alla concentrazione di 25 mg e 50 mg per 6 settimane13. Questo studio ha dimostrato che il farmaco ha effetti benefici sull’uptake di glucosio epatico e periferico grazie ad un miglioramento dell’insulino-sensibilità. Tuttavia, a causa della breve durata del trattamento non sono stati valutati parametri clinici importanti come l’emoglobina glicata. Inoltre, è stata osservata una significativa perdita di peso dose-dipendente nei pazienti trattati con OCA ed un miglioramento della fibrosi epatica, dimostrando una buona sicurezza e tollerabilità del farmaco13. In seguito ai risultati ottenuti, è stato poi effettuato lo studio FXR Ligand NASH Treatment (FLINT) in cui sono stati arruolati circa 280 pazienti americani affetti da NASH somministrando placebo o 25 mg di OCA per 72 settimane14. I pazienti trattati con OCA hanno mostrato un miglioramento epatico dal punto di vista istologico, caratterizzato da una riduzione della fibrosi, della steatosi e dell’infiammazione lobulare. Inoltre, il trattamento con OCA è stato associato a riduzione del peso corporeo e della pressione sanguigna. Va sottolineato però che il 23% dei pazienti trattati con il farmaco ha manifestato prurito14 e che una certa cautela va mantenuta sugli effetti a carico del metabolismo del colesterolo per l’eventuale aumento della concentrazione dello stesso nel siero dei pazienti. Quindi, lo studio FLINT ha dimostrato che l’OCA è in grado di migliorare le caratteristiche istologiche dei pazienti con NASH ma ulteriori studi sono necessari al fine di chiarire la sicurezza a lungo termine di questo farmaco. Sono peraltro in studio una serie di nuovi composti in grado di attivare FXR e molti di essi hanno struttura chimica differente da quella degli acidi biliari e sono già in fase sperimentale sull’uomo. Pertanto numerosi studi clinici sono in corso sull’uomo sia con composti in grado di attivare FXR, rilevanti in patologie epatiche come colestasi e NASH, sia con analoghi dell’ormone FGF19 che mantengono l’attività prometabolica di questa enterochina ma sono privi dell’attività protumorale.Data di Redazione 02/2018