Broncopneumopatia cronica ostruttiva

Leonardo M. Fabbri
Dipartimento di Scienze Mediche, Università di Ferrara - Sahlgresnska University-Hospital, Gothenburg, Sweden
Dipartimento di Scienze Mediche, Università di Ferrara - Sahlgresnska University-Hospital, Gothenburg, Sweden
Bianca Berghé
Dipartimento di Scienze Medico-Chirurgiche Materno Infantili e dell'Adulto, Università di Modena e Reggio Emilia. Modena
Dipartimento di Scienze Medico-Chirurgiche Materno Infantili e dell'Adulto, Università di Modena e Reggio Emilia. Modena
Enrico M. Clini
Dipartimento di Scienze Medico-Chirurgiche Materno Infantili e dell’Adulto, Università di Modena Reggio Emilia. Modena
Dipartimento di Scienze Medico-Chirurgiche Materno Infantili e dell’Adulto, Università di Modena Reggio Emilia. Modena



 Nella realtà clinica, l’acronimo BPCO non identifica una singola alterazione anatomica, ma racchiude due quadri anatomopatologici distinti in un’unica definizione. Infatti, l’ostruzione cronica bronchiale patognomonica della BPCO è dovuta in parte al rimodellamento e all’infiammazione delle vie aeree indotti dalla infiammazione cronica ed in parte alla distruzione della superficie alveolare con perdita della trazione elastica da essa esercitata sui bronchioli (enfisema).
Nella realtà clinica, l’acronimo BPCO non identifica una singola alterazione anatomica, ma racchiude due quadri anatomopatologici distinti in un’unica definizione. Infatti, l’ostruzione cronica bronchiale patognomonica della BPCO è dovuta in parte al rimodellamento e all’infiammazione delle vie aeree indotti dalla infiammazione cronica ed in parte alla distruzione della superficie alveolare con perdita della trazione elastica da essa esercitata sui bronchioli (enfisema). Il soggetto con BPCO, quindi, ha bisogno di un tempo espiratorio più lungo per completare la normale espirazione (tanto più prolungato quanto più basso è il flusso espiratorio). In queste condizioni l’inspirazione successiva potrebbe iniziare prima che il polmone abbia raggiunto il punto di equilibrio elastico (cioè il punto in cui il richiamo elastico del polmone verso l’interno è controbilanciato dal richiamo della parete toracica verso l’esterno) e avvenire quindi a volumi polmonari più alti. Il respiro a volumi polmonari più elevati determina uno stato di iperdistensione caratterizzato da un aumento del volume residuo e della capacità funzionale residua e da una diminuzione della capacità inspiratoria. A questa conseguono un incremento del lavoro respiratorio e un aumento della sensazione di dispnea, che negli stadi iniziali della malattia compare tipicamente durante l’esercizio, ma negli stadi più avanzati può essere presente anche a riposo
Il soggetto con BPCO, quindi, ha bisogno di un tempo espiratorio più lungo per completare la normale espirazione (tanto più prolungato quanto più basso è il flusso espiratorio). In queste condizioni l’inspirazione successiva potrebbe iniziare prima che il polmone abbia raggiunto il punto di equilibrio elastico (cioè il punto in cui il richiamo elastico del polmone verso l’interno è controbilanciato dal richiamo della parete toracica verso l’esterno) e avvenire quindi a volumi polmonari più alti. Il respiro a volumi polmonari più elevati determina uno stato di iperdistensione caratterizzato da un aumento del volume residuo e della capacità funzionale residua e da una diminuzione della capacità inspiratoria. A questa conseguono un incremento del lavoro respiratorio e un aumento della sensazione di dispnea, che negli stadi iniziali della malattia compare tipicamente durante l’esercizio, ma negli stadi più avanzati può essere presente anche a riposo.png)
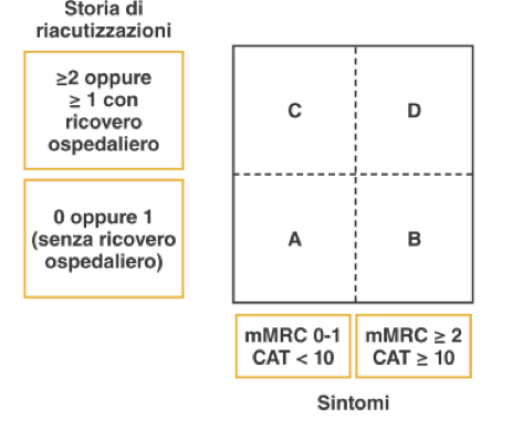
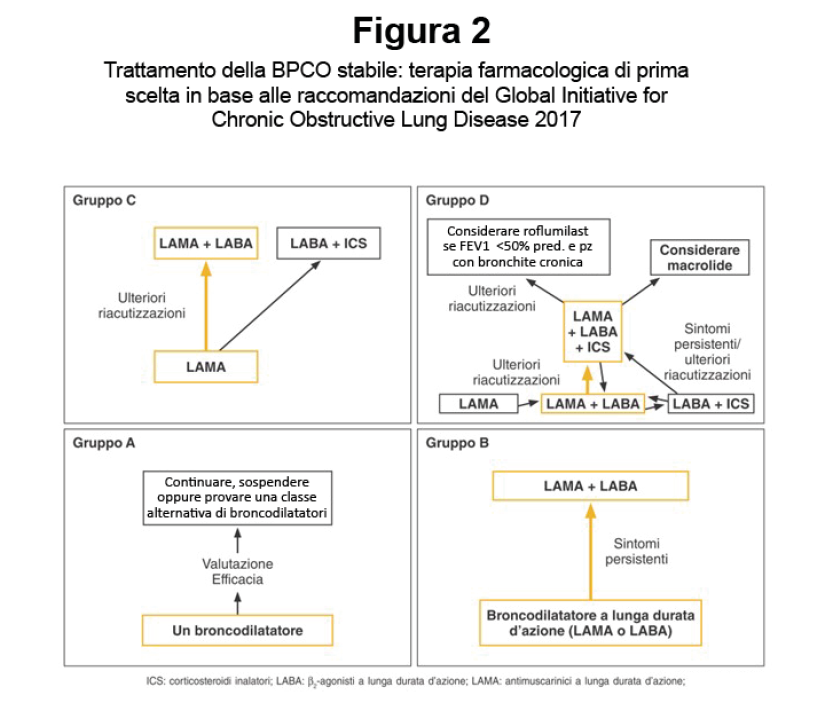
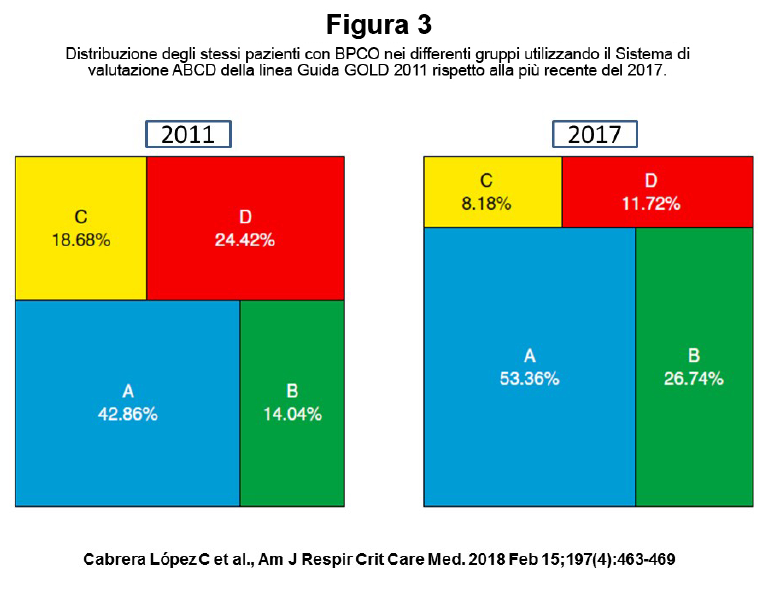
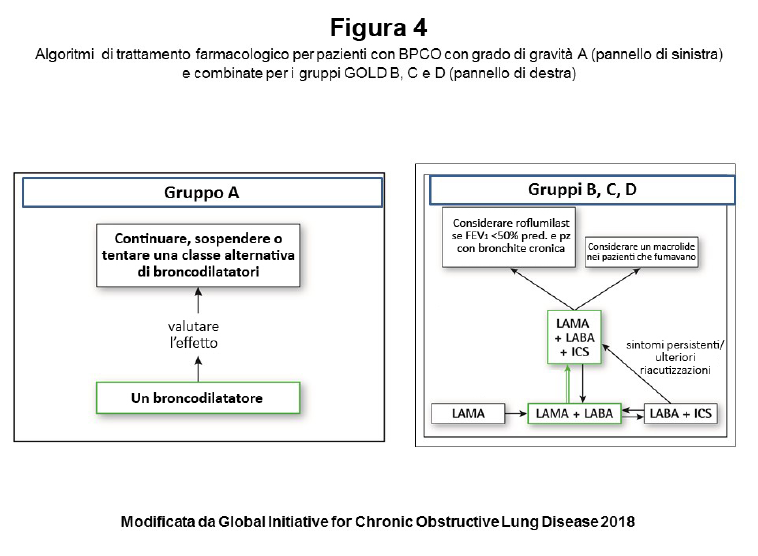
 La dimostrazione spirometrica di un’ostruzione bronchiale non reversibile è fondamentale per confermare la diagnosi di BPCO. La presenza di ostruzione bronchiale non reversibile viene definita per convenzione da un rapporto tra il Volume Espiratorio Massimo nel primo Secondo di espirazione massima [VEMS, o Forced Expiratory Volume in One Second (FEV1)] e la Capacità Vitale Forzata [CVF, o Forced Vital Capacity (FVC)] inferiore a 0,7 misurato 15-30 minuti dopo l’assunzione di broncodilatatore inalatorio β2-agonista o anticolinergico (400 µg di salbutamolo e/o 80 µg di ipratropio bromuro). Questo risultato indica che nel primo secondo di espirazione viene mobilizzato meno del 70% di tutta l’aria mobilizzabile in una manovra espiratoria forzata e completa a partire dalla Capacità Polmonare Totale (CPT). La persistenza dell’ostruzione bronchiale anche dopo somministrazione di broncodilatatore inalatorio rappresenta la caratteristica peculiare nella BPCO. Le linee guida nazionali e internazionali indicano il FEV1 e il rapporto FEV1/FVC come i parametri funzionali essenziali per la diagnosi e la prognosi, ma non più così essenziali per la valutazione di gravità clinica dell’individuo (vedi oltre), né come parametro di riferimento per la impostazione della terapia
La dimostrazione spirometrica di un’ostruzione bronchiale non reversibile è fondamentale per confermare la diagnosi di BPCO. La presenza di ostruzione bronchiale non reversibile viene definita per convenzione da un rapporto tra il Volume Espiratorio Massimo nel primo Secondo di espirazione massima [VEMS, o Forced Expiratory Volume in One Second (FEV1)] e la Capacità Vitale Forzata [CVF, o Forced Vital Capacity (FVC)] inferiore a 0,7 misurato 15-30 minuti dopo l’assunzione di broncodilatatore inalatorio β2-agonista o anticolinergico (400 µg di salbutamolo e/o 80 µg di ipratropio bromuro). Questo risultato indica che nel primo secondo di espirazione viene mobilizzato meno del 70% di tutta l’aria mobilizzabile in una manovra espiratoria forzata e completa a partire dalla Capacità Polmonare Totale (CPT). La persistenza dell’ostruzione bronchiale anche dopo somministrazione di broncodilatatore inalatorio rappresenta la caratteristica peculiare nella BPCO. Le linee guida nazionali e internazionali indicano il FEV1 e il rapporto FEV1/FVC come i parametri funzionali essenziali per la diagnosi e la prognosi, ma non più così essenziali per la valutazione di gravità clinica dell’individuo (vedi oltre), né come parametro di riferimento per la impostazione della terapia