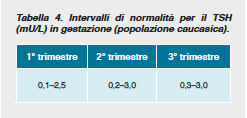
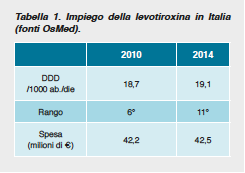
 Il diffuso impiego del prodotto può essere attribuito a diversi motivi; tra essi:
Il diffuso impiego del prodotto può essere attribuito a diversi motivi; tra essi: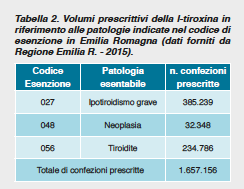 È comunque ipotizzabile che circa un 50% dei trattamenti con l-T4 sia assunto da persone con indicazioni discutibili o francamente inappropriate con un margine di risparmio non trascurabile considerando una spesa complessiva di oltre 4.700.000 € per la sola Emilia Romagna.
È comunque ipotizzabile che circa un 50% dei trattamenti con l-T4 sia assunto da persone con indicazioni discutibili o francamente inappropriate con un margine di risparmio non trascurabile considerando una spesa complessiva di oltre 4.700.000 € per la sola Emilia Romagna. Nonostante i numerosi dati osservazionali, soprattutto per le aree di maggiore controversia31, esiste un “bisogno urgente” di risultati provenienti da studi randomizzati di buona qualità su esiti clinicamente rilevanti32.
Nonostante i numerosi dati osservazionali, soprattutto per le aree di maggiore controversia31, esiste un “bisogno urgente” di risultati provenienti da studi randomizzati di buona qualità su esiti clinicamente rilevanti32.