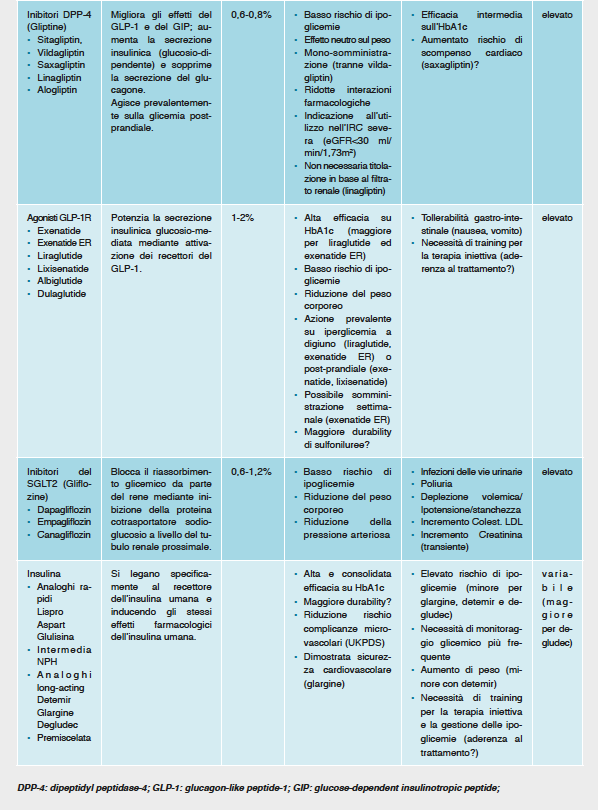
La necessità di personalizzare la terapia per il diabete ha portato l’Agenzia Italiana del Farmaco a sviluppare un algoritmo elettronico come strumento di appropriatezza prescrittiva e prescrivibilità in linea con le evidenze disponibili. L’Algoritmo per la gestione del trattamento per il diabete di tipo 2 è stato sviluppato in base alle linee-guida nazionali ed internazionali e alle migliori evidenze disponibili e condiviso con la Società Italiana di Diabetologia (SID) e l’Associazione Medici Diabetologi (AMD), per supportare il clinico nel complesso compito di prescrivere la terapia più adeguata in base a ciò che è effettivamente rimborsato.
La necessità di personalizzare la terapia per il diabete ha portato l’Agenzia Italiana del Farmaco a sviluppare un algoritmo elettronico come strumento di appropriatezza prescrittiva e prescrivibilità in linea con le evidenze disponibili. L’Algoritmo per la gestione del trattamento per il diabete di tipo 2 è stato sviluppato in base alle linee-guida nazionali ed internazionali e alle migliori evidenze disponibili e condiviso con la Società Italiana di Diabetologia (SID) e l’Associazione Medici Diabetologi (AMD), per supportare il clinico nel complesso compito di prescrivere la terapia più adeguata in base a ciò che è effettivamente rimborsato.
 Più recentemente, sempre nell’ambito degli inibitori del DPP-4, lo studio TECOS (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) ha valutato la sicurezza cardiovascolare a lungo termine del sitagliptin31 in pazienti con diabete di tipo 2 e patologia cardiovascolare. Lo studio ha confermato i risultati dei trial precedenti: l’aggiunta di sitagliptin alla terapia standard non aumentava il rischio cardiovascolare.
Più recentemente, sempre nell’ambito degli inibitori del DPP-4, lo studio TECOS (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) ha valutato la sicurezza cardiovascolare a lungo termine del sitagliptin31 in pazienti con diabete di tipo 2 e patologia cardiovascolare. Lo studio ha confermato i risultati dei trial precedenti: l’aggiunta di sitagliptin alla terapia standard non aumentava il rischio cardiovascolare.