Lo pneumococco (Pn) (Streptococcus pneumoniae) è un patogeno respiratorio responsabile sia in età pediatrica che adulta di elevata morbilità e, particolarmente nel Terzo mondo, di elevata mortalità; l'immunizzazione attiva della popolazione potrebbe essere un efficace mezzo difensivo, ma la preparazione di un valido vaccino antipneumococcico (PCV) è complicata dal fatto che sono attualmente conosciuti almeno 90 sierotipi 1 con diverso potenziale patogeno, variamente circolanti nelle diverse zone geografiche.
Vaccini disponibili Contro il Pn è disponibile da anni un vaccino polisaccaridico rivolto contro i 23 sierotipi più frequentemente protagonisti di infezione (1, 2, 3, 4, 5,6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14,15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F); tale vaccino, però, non è indicato nei bambini fino a due anni di età e, per la sua incapacità di stimolare la memoria immunitaria, esaurisce il suo effetto in pochi anni 2,3. La coniugazione con proteine carrier determina invece una migliore e più duratura risposta immunologica 2, per cui i vaccini coniugati sono somministrabili anche nella prima infanzia rendendo possibili programmi di immunizzazione universale. Il 30 aprile 2010 è stata autorizzata anche in Italia la commercializzazione di PCV13 4, che amplia la copertura dei ceppi responsabili di malattie invasive (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) rispetto ai precedenti vaccini coniugati 7-valente (4, 6B, 9V, 14, 18C, 19F, 23F) e 10-valente (1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F). A partire dal 2003, in modo graduale e disomogeneo, la vaccinazione con PCV7 si è diffusa in tutta Italia giungendo nel 2008 a interessare la maggior parte dei neonati 5; attualmente il vaccino è offerto in modo attivo e gratuito in quasi tutto il territorio nazionale 6.
Peso sociale della malattia pneumococcica in Italia
Il Pn è responsabile di un'elevata mortalità infantile, nell'ordine di un milione di decessi/anno in tutto il mondo; tali decessi sono riferibili per lo più a polmonite e avvengono nella stragrande maggioranza dei casi nei Paesi in via di sviluppo, essendo attribuibili essenzialmente al cattivo stato nutrizionale associato alla difficoltà di accesso a cure mediche adeguate 7. Nei Paesi con livelli socio-economici e sistemi sanitari efficienti come l'Italia, le preoccupazioni sono invece determinate dalle più rare malattie pneumococciche invasive (MPI), che sono in genere definite in base all'isolamento del patogeno dal liquor o dal sangue, oppure dall'isolamento di un suo antigene dal liquor con successiva conferma tramite PCR 8. La valutazione del peso sociale della MPI in Italia è controversa, anche perché la sua definizione non è sempre omogenea. Da un lato si ritiene che la valutazione sia sottostimata e si chiede con motivazioni ragionevoli di implementare fortemente i metodi di diagnosi molecolare (PCR-RT) che sono più sensibili della coltura e che quindi determinano un notevole incremento dell'incidenza di patologia attribuibile al Pn; dall'altro lato si ritiene necessario fare una chiara distinzione in base al rischio di danno biologico, dato che le otiti medie acute (OMA), le polmoniti (batteriemiche o no), le artriti, le batteriemie occulte provocate da Pn concorrono indubbiamente a determinare un carico sociale valutabile in termini di impegno di spesa e di risorse del sistema, ma sono in genere perfettamente curabili; le sepsi e le meningiti sono invece patologie potenzialmente capaci di provocare rischio di vita e/o invalidità. È in riferimento alla possibilità di contrastare queste malattie (che chiameremo MPI gravi) che si gioca la possibilità di ricevere un consenso generale per la vaccinazione. Il Piano Nazionale Vaccini (PNV) 2005-2007 ha preso in considerazione, sulla base di piccoli studi non controllati e non confermati, incidenze fino a 64 casi/ 100.000 9-11, ma solo una piccola parte di questi erano MPI gravi. Studi successivi maggiormente affidabili hanno riportato incidenze più contenute: 6,4/100.000 in Puglia e 11/100.000 in Piemonte, ma anche in questi casi sono state considerate molte batteriemie occulte e non solo MPI gravi 12. L'Istituto Superiore di Sanità (ISS) tiene conto dal 1994 delle meningiti occorse in Italia 13; dal 1997 la sorveglianza è stata estesa, ove possibile, all'identificazione del ceppo responsabile; dal 2007 vengono monitorate anche altre malattie invasive diverse da meningite; si tratta in genere di sepsi, ma non solo. Il sistema di sorveglianza fa riferimento essenzialmente a criteri di diagnosi colturale; solo per la Toscana si fa riferimento alla diagnosi molecolare. Secondo dati aggiornati a settembre 2010, non ancora definitivi ma abbastanza stabilizzati, il 2009 è stato l'anno con il maggior numero di eventi (720, frequenza di circa 1,2/100.000 nella popolazione generale); nel 2008 c'è stato invece il massimo di eventi nella fascia di età 0-4 anni (87, meno di 4/100.000); l'incidenza sembra quindi essere molto inferiore a quanto prospettato nonostante l'uso di una definizione di MPI non restrittiva. Per valutare l'incidenza reale di MPI è stata realizzata in Toscana una ricerca attiva che ha utilizzato metodi di diagnosi molecolare; è stata dimostrata un'incidenza di 52/100.000 < 2 anni e 35/100.000 <5 anni 14; la maggior parte degli eventi diagnosticati erano però polmoniti batteriemiche; considerando le sole MPI gravi, l'incidenza, anche con sistemi di diagnosi molecolare nell'ambito di una ricerca attiva piuttosto che in un contesto di segnalazione spontanea, è di 5,7/100.000 < 2 anni e 4,7/100.000 <5 anni, perfettamente in linea con i dati nazionali. Il dato ridimensiona la misura del fenomeno di "sottonotifica" che, per queste patologie di notevole gravità, appare (come è logico aspettarsi) meno frequente del solito (Figura 1).
Effetto del PVC7 in Italia
Le tabelle dell'ISS 13 mettono purtroppo in evidenza che, negli anni successivi all'avvento del PCV7, non c'è stata nessuna riduzione del numero di meningiti pneumococciche in Italia (Figura 2). Ciò non può essere attribuito al non elevato tasso di copertura vaccinale dovuto alla diffusione a manto di leopardo sul territorio nazionale, frutto anche questo di una "novità" introdotta con questo vaccino: la deprecabile rinuncia a una gestione unitaria a favore dell'autodeterminazione delle Regioni. Non ci sono dati nazionali ufficiali, ma lo studio Icona 2008 indica una stima di copertura vaccinale nazionale del 55,1% in costante aumento 5 e comunque l'estrapolazione dei dati delle prime otto Regioni che hanno introdotto il vaccino (e che quindi hanno un tasso di copertura maggiore) ugualmente non fa vedere nessun calo del numero di meningiti pneumococciche (Figura 3).
Effetto del PVC7 sulle MPI in Europa e in USA
Allo stesso modo sono deludenti i dati riscontrati in Francia, dove a una riduzione di casi in età < 2 anni si accompagna un aumento in tutte le altre fasce di età, tanto che il totale delle meningiti aumenta del 9% e quello delle sepsi del 20% 15,16; ricordiamo che in età pediatrica il rischio di morte per MPI grave è nettamente più basso (8,4%) che negli adulti (22,3%) 17. L'effetto non è automaticamente attribuibile alla vaccinazione, ma si è ripetuto spesso dopo la vaccinazione. Anche nel Regno Unito 18 e in Olanda 19, infatti, il mancato effetto di herd immunity ha controbilanciato i benefici ottenuti nella sola fascia di età <2 anni, anche a fronte di coperture elevate (addirittura > 94% in Olanda); questa osservazione fa considerare non vantaggioso il PCV7 e possibilmente vantaggioso il PCV10 o PCV13 in un recente studio olandese sul costo/beneficio 20. In Spagna, nella regione di Barcellona, dopo l'introduzione della vaccinazione c'è stato addirittura un aumento di tutte le MPI, anche quelle <2 anni, con l'unico risultato positivo di una riduzione dei ceppi antibiotico-resistenti 21. Diversi sono stati i risultati ottenuti negli USA: lo studio di H. Hsu è confrontabile con i dati italiani perché considera solo gli effetti sulle meningiti: l'introduzione del PCV7 coincide con un calo complessivo del 30% dei casi, frutto di una sommatoria tra la riduzione del 67% dei casi dovuti a ceppi vaccinali e l'aumento del 60% dei casi dovuti a ceppi non vaccinali. Questo dimostra quanto sia scorretto generalizzare i dati di un Paese a realtà diverse da quelle studiate 17 .
Il rimpiazzo
Il fenomeno di cambiamento dei ceppi responsabili di MPI, anche se in misura diversa, si è ripetuto in Spagna 21, in Olanda 19, in Francia 15 (dove, dopo un solo anno di vaccinazione universale, nel 2007 i ceppi vaccinali PCV7 erano responsabili ormai solo del 16% delle MPI [16]). Un ulteriore segnale di allarme viene dalla Gran Bretagna, dove lo scorso anno quasi la metà delle circa 4000 MPI avutesi nei soggetti >5 anni sono state causate da ceppi non vaccinali del PCV13 (a fronte di solo 500 MPI causate da ceppi vaccinali PCV7) 18.
I ceppi di pneumococco circolanti in Italia
Il PNV 2005-2007 affermava che i ceppi vaccinali del PCV7 erano responsabili in Italia dell'80% delle MPI 22; le tabelle pubblicate da Epicentro 23 certificano invece che solo il 49% delle meningiti pneumococciche erano in quegli anni causate da ceppi vaccinali; questa discrepanza può spiegare l'insuccesso della vaccinazione con PCV7; dopo l'introduzione del vaccino tale percentuale si è rapidamente ulteriormente ridotta al 30% (Figura 4, Tabella I).
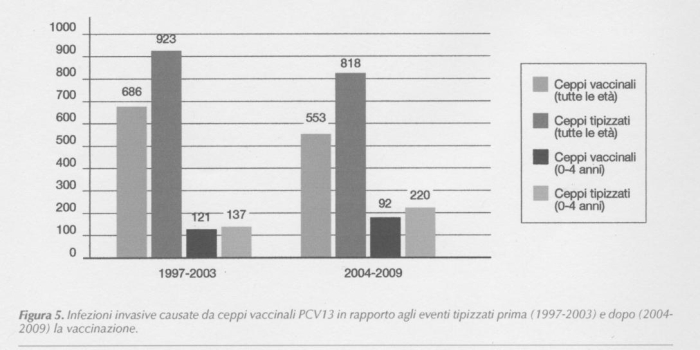
Se consideriamo la sola fascia di età fino a 4 anni, i ceppi vaccinali PCV7 erano responsabili del 64% delle meningiti nel periodo pre-vaccinale, ridotti al 42% degli eventi dopo l'avvio della vaccinazione (Figura 4, Tabella II). Nel periodo pre-vaccinale il 74% delle meningiti tipizzate era causato da ceppi vaccinali del PCV13 ma dopo l'uso dell'eptavalente tale percentuale si è ridotta al 68%; un terzo delle MPI è quindi oggi in Italia fuori dallo spettro di protezione del PCV13 (Figura 5, Tabella III).

 L'esperienza di alcune Regioni italiane
L'esperienza di alcune Regioni italiane
Manca uno standard sulla sorveglianza delle MPI e ogni Regione segue un proprio percorso; ciò rende teoricamente plausibile l'ipotesi di una sottovalutazione della reale incidenza. Liguria: è la prima Regione italiana ad aver introdotto il PCV7 nel suo calendario vaccinale nel 2003, raggiungendo rapidamente una copertura del 93,4%; ha avuto il merito di monitorarne gli effetti analizzando i tassi di ospedalizzazione di tre coorti di nati prima e tre coorti di nati dopo l'introduzione del vaccino 24. I dati vengono presentati in percentuale e dimostrano una riduzione dei ricoveri per OMA (-36%) e per polmonite (-16%; -70% quelle pneumococciche); tale riduzione è statisticamente significativa. La consistenza numerica appare però irrilevante ai fini della giustificazione della vaccinazione universale: con la vaccinazione di una coorte di circa 12.000 nati i ricoveri annui per OMA da 45/10.000 diventano 29/10.000; quelli per polmonite da 65 diventano 55/10.000; di questi, i ricoveri per polmonite da Pn da 1,91/10.000 diventano 0,56/10.000. Contemporaneamente, invece dell'auspicato calo, si evidenzia un aumento (anche se statisticamente non significativo) dei ricoveri pediatrici per meningite pneumococcica, che da 2,3 passa a 2,9/10.000 (+ 25%), e per sepsi, che da 8,5 passa a 12/10.000 (+ 40%). Non si dice nulla in merito ai ceppi circolanti e al loro eventuale rimpiazzo.
Lombardia: nel periodo 2007-2009 (quando la Regione non offriva gratuitamente il vaccino) sono stati registrati 52 casi di MPI <5 anni; 9 soggetti (il 20%) risultavano vaccinati e hanno sviluppato patologia da ceppi non vaccinali. Solo il 30% dei 52 ceppi erano ceppi vaccinali PCV7 e solo il 65% erano ceppi vaccinali PCV13; copertura vaccinale intorno al 60% 25.
Emilia Romagna: il PCV7 è stato introdotto in calendario regionale nel 2006; copertura nel 2008: 95,8%. L'incidenza delle MPI nel periodo 2007-2009 è stata di 1,6/100.000, in linea con le basse incidenze nazionali. La media delle meningiti riscontrate nel periodo pre-vaccinale è stata di 32 episodi/anno; nel periodo vaccinale tale frequenza si è ridotta a 29,25 meningiti/anno 26. Anche ricerche attive e sistemi di sorveglianza regionali efficienti confermano quindi la bassa incidenza delle MPI gravi e la scarsa efficacia del PCV7.
Le polmoniti
La mortalità attribuibile a Pn è dovuta essenzialmente al gran numero di polmoniti che si verificano nei Paesi poveri, dove una condizione di cronica malnutrizione si associa a scadenti condizioni socio-ambientali e a difficoltà nell'accesso alle cure 7. Una metanalisi di soli tre studi condotti in USA, Gambia, Sud Africa con un vaccino 7-e uno 9-valente attribuisce una riduzione di circa il 6% delle polmoniti diagnosticate clinicamente e del 30% di quelle confermate con radiografia 27. Uno studio di sorveglianza USA registra invece una lieve riduzione di polmoniti solo nella fascia di età fino a un anno e nessun effetto nei bambini più grandi e negli adulti 28. D'altro canto è stato segnalato un po' in tutto il mondo l'aumento dei casi complicati con empiema; in particolare, uno studio americano di sorveglianza nella popolazione dello Utah <18 anni evidenzia che da 24 casi di empiema pleurico pneumococcico su 137 casi di malattia invasiva pneumococcica avuti nel periodo pre-vaccinale (19962000) si è passati a 50 empiemi su 158 malattie invasive nel periodo post-vaccinale (2001-2004) 24. Anche questi dati (come quelli della Liguria visti in precedenza) ci confermano nel giudizio che la vaccinazione universale sia difficilmente giustificabile (e sicuramente poco accettata dalla popolazione) se adottata in Italia con questa finalità.
Discussione Una Circolare Ministeriale fornisce indicazioni per il passaggio dal PCV7 al PCV13; riconoscendo implicitamente l'acclarata inadeguatezza del PCV7, consiglia una somministrazione di PCV13 anche nei bambini <24 mesi che hanno già completato il ciclo vaccinale con PCV7. Questo rappresenta un ulteriore aumento di costi e di impegno del Sistema precedentemente non previsti 30. Anche noi speriamo che l'allargamento dello spettro di ceppi vaccinali comporti, come sembra ovvio aspettarsi, un miglioramento delle performance del vaccino, ma ci saremmo augurati che l'occasione fosse stata utilizzata anche per fornire un chiarimento sui tanti punti controversi.
Conclusioni
Quello che rende diverso il PCV dagli altri vaccini raccomandati nel calendario di Sanità pubblica è l'aura di poca chiarezza che lo contraddistingue. Per un operatore che deve offrire al vaccinando le migliori informazioni possibili per una scelta consapevole, è facile definire lo scopo e gli effetti degli altri vaccini raccomandati: lo scopo è quello di eliminare malattie potenzialmente pericolose e non curabili, molto diffuse in mancanza di vaccinazione, attraverso l'eliminazione dello specifico microrganismo (anti-polio, pertosse, Hi, epatite B, morbillo, rosolia, parotite) o impedendo ai suoi strumenti di offesa di agire (anti-tetano, difterite). A parte gli ovvi miglioramenti tecnici, quei vaccini sono uguali a se stessi da decenni e i loro effetti positivi (maggiori o minori secondo i casi) sono dimostrati dal calo delle patologie affrontate. Quando è stato introdotto il PCV7, essendo "a priori" improponibile l'eliminazione della MP, non era invece chiaro quale fosse l'obiettivo (evitare le MPI gravi o le infezioni respiratorie); non era chiara la rilevanza di queste patologie nel nostro Paese, per cui si sono presi in considerazione dati che sovrastimavano fortemente le MPI gravi; si è anche sovrastimata la capacità protettiva del vaccino; non si è dato il rilievo dovuto al rischio (poi realizzatosi) di veder vanificarsi gli effetti a causa del rimpiazzo dei ceppi patogeni. C'è stato qualche inascoltato richiamo a un atteggiamento prudente di attesa 41: la MP non si presentava come un'emergenza sanitaria e quindi non c'era la fretta di dover agire con immediatezza. I dati, oltre che confusi, erano spesso forniti dall'azienda produttrice del vaccino o presi da realtà sociali-economiche-etniche diverse e quindi poco utili a stabilire l'appropriatezza dell'intervento. Mancava un adeguato sistema di sorveglianza che si chiedeva a gran voce di predisporre. Bisognava migliorare la formazione tecnica del personale. Si è scelta la strada di introdurre il vaccino nonostante le incertezze testimoniate anche dai tanti condizionali con cui si esprimeva il PNV 2005- 2007. Continua però a mancare ogni tipo di report ufficiale (a parte le tabelle dell'ISS); non si conosce neppure il tasso di copertura nazionale; la sorveglianza è approssimativa (l'identificazione dei sierotipi è anzi in calo); gli opinion leader riconoscono l'esistenza del rimpiazzo solo ora che è disponibile un vaccino contro alcuni dei ceppi emergenti, ma si trascura di sottolineare che ce ne sono tanti altri che non vedono l'ora di lasciare la panchina e scendere in campo, come dimostra l'efficiente sistema di sorveglianza inglese. Il quadro non è ottimistico: la MP fa vittime dove il vaccino non c'è e comunque anche lì probabilmente sarebbero più utili interventi di altro tipo. Nei Paesi ricchi si vive invece un incredibile paradosso: la MPI grave ha una frequenza non molto alta e il vaccino produce risultati meno buoni del previsto, con grande assorbimento di risorse. Non sarà facile venir fuori da questo pasticcio; la vaccinazione anti-pneumococcica non ci sembra garantire tutti i criteri di appropriatezza che sono richiesti, ma crediamo che ben difficilmente sarà rimessa in discussione; crediamo però che un Servizio Sanitario in grado di permettersela, se vuole mostrarsi credibile, dovrebbe garantire quella sorveglianza efficace e puntuale sempre promessa e mai compiutamente strutturata, un sistema di report che faccia tornare al territorio tutte le informazioni utili e necessarie, un adeguamento di strutture e mezzi adeguati ai servizi moderni, un programma di formazione efficace, uno stanziamento di risorse materiali e di energie che permetta finalmente di centrare gli obiettivi prioritari fissati da tanti anni. Crediamo infine nel bisogno di un dibattito aperto e non conformistico che permetta a operatori e utenti di accedere a una informazione chiara e completa, unico strumento capace di garantire una adesione matura e convinta ai programmi di vaccinazione raccomandati.
1.American Academy of Pediatrics. Rapporto del Comitato sulle malattie infettive. Red Book ed. 2009 - Capitolo Pneumococco: 524-35.
2.Siegrist CA. Vaccine Immunology. General Aspect of Vaccination: 17-37.
3. Weekly Epidemiological record 23 March 2007, 82nd Year / No. 12, 2007, 82, 93 -104;www.who.int/wer
4.Delibera AIFA del 16-04-2010. GU n° 100 del 30-04-2010.
5.www.iss.it rapporti Istisan 09/29 Studio ICONA 2008.
6.Vaccinare oggi & domani, anno 2010-vol.1Suppl.al fascicolo 1, Introduzione degli Autori.
7.Wardlaw TM, Johansson EW, Hodge M. Pneumonia, the forgotten killer of the children; www.who.int/child_adolescent_health/documents/9280640489/fr/index.html.
8.Protocollo per la Sorveglianza delle malattie infettive da Streptococcus pneumoniae in Piemonte e Puglia; epidem.aslal.it/uploads/documen-ti/17_protocollo_pnc.PDF.
9.Piano Nazionale Vaccini 2005-2007; GU, Suppl ordinario 14 aprile 2005, pag. 33.
10.Castiglia P, Gallisai D, Sotgiu G. Epidemiology of invasive pneumococcal infections in Sardinian children; Poster of ISPPD-4 Helsinki 2004 (4° Simposio Internazionale sulle patologie da Pneumococco).
11.Romano G, Poli A, Tardivo S. Invasive pneumococcal diseases in age group 0-36 months: results from a perspective surveillance program in Northerneastern Italy. Poster of ISPPD-4, Helsinki 2004.
12.D'Ancona F, Salmaso S, Barale A, et al.and Italian PNC-Euro Working Group. Incidence of vaccine preventable pn. Invasive infections and blood colture practices in Italy. Vaccine 2005; 23:2494-500.
13.//www.simi.iss.it/dati.htm.
14.Azzari C, Moriondo M, Indolfi G, et al. Molecular detection methods and serotyping performed directly on clinical samples improve diagnostic sensitivity and reveal increate incidence of invasive disease by Streptococcus pneumoniae in Italian children. J Med Microbiol 2008; 57:1205-12.
15.Lepoutre A, Varon E, Georges S, Gutmann L, Lévy-Bruhl D. Impact of infant pneumococcal vaccination on invasive pneumococcal diseases in France, 2001-2006. Euro Surveill 2008; 13(35).pii:18962.
16.Haut Conseil de la Santé Publique AVIS relatif à la vaccination par le vaccin pneumococcique conjugué 13-valent, 11 décembre 2009; www.hcsp.fr.
17.Hsu HE, Shutt KA, Moore MR, et al. Effect of Pneumococcal Conjugate Vaccine on Pneumococcal Meningitis. N Engl J Med 2009; 360:244-56.
18.Kaye P, Malkani R, Martin S, e al. IPD in England & Wales after PCV7; potential impact of 10 and 13-valent vaccines;www. hpa.nhs.uk/Topics/InfectiousDiseases/Infect ionsAZ/Pneumococcal/.
19. Rodenburg GD, de Greeff SC, Jansen AG, et al. Effects of pneumococcal conjugate vaccine 2 years after its introduction, the Netherlands Emerging Infectious Diseases; www. cdc.gov/eid. Vol. 16, No. 5, May 2010.
20. Rozenbaum MH, Sanders EAM, van Hoek AJ, et al. Cost effectiveness of pneumococcal vaccination among Dutch infants: economic analysis of the seven valent pneumococcal conjugated vaccine and forecast for the 10 valent and 13 valent vaccines. BMJ 2010; 340: c2509.
21.Almagro CM, Jordan I, Gene A, Latorre C, Garcia-Garcia JJ, Pallares R. Emergence of invasive pneumococcal disease caused by non vaccine serotypes in the era of 7-valent conjugate vaccine. Clin Infect Dis 2008; 46:174-82.
22.Piano Nazionale Vaccini 2005-2007. GU, Suppl. ordinario 14 aprile 2005, pag. 36.
23.www.epicentro.iss.it/temi/infettive/pdf/tabelle-sito-simi2.pdf.
24.Durando P. Crovari P, Ansaldi F, et al. Universal childhood immunisation against Streptococcus pneumoniae: The five-year experience of Liguria Region, Italy. Vaccine 2009; 27:3459-62.
25.www.sanita.regione.lombardia.it/ cs/Satellite?c=Redazionale_P&childpagenam e=DG_Sanita/Detail&cid=1213323009201&packedargs=menu-to-render%3D1213277- 441847&pagename=DG_SANWrapper&rendermode=previewnoinsite.
26.www.epicentro.iss.it/regioni/emilia/ pdf/malattieInvBattER09.pdf.
27.Pavia M, Bianco A, Nobile CGA, Marinelli,P, Angelillo IF. Efficacy of pneumococcal vaccination in children younger than 24 months: a metaanalysis.Pediatrics 2009; 123:e1103-e1110.
28. Nelson JC, J.ackson M, Yu O, et al. Impact of the introduction of pneumococcal conjugate vaccine on rates of community acquired pneumonia in children and adults. Vaccine 2008; 26: 4947-54.
29.Byington CL, Korgenski K, Daly J, Ampofo K,Pavia A, Mason EO. Impact of the pneumococcal conjugate vaccine on pneumococcal parapneumonic empyema. Pediatr Infect Dis J 2006; 25:250- 4.
30.Ministero della Salute. Circolare 0024720-P del 27-05-2010.
31.Piano Nazionale Vaccini 2005-2007. GU Suppl. ordinario 14 aprile 2005, pag. 30-31.
32.www.ministerodellasalute.it/malattieinfettiveevaccinazioni/ coperture.
33.Piano Nazionale Vaccini 1998-2000 PAG 17; docs.google.com/viewer?a=v&q=cache:1Hj7rDSOb4J:www.salute.gov.it/
34.Piano Nazionale per l'eliminazione di morbillo e rosolia congenital. GU Suppl. ordinario n° 195 al n° 297 del 23-12-2003;www.governo.it/backoffice/allegati/20894-1712. pdf.
35.www.epicentro.iss.it/focus/morbillo/morbillo.asp.
36.Giambi C, Filia A, Ciofi degli Atti ML, Rota MC, Salmaso S. Allarme rosolia: promuovere gli interventi per vaccinare le donne suscettibili in età fertile. B. e. n. Vol. 21 numero 5 maggio 2008; ttp://www.epicentro.iss.it/ben/2008/maggio/1.asp.
37.Gruppo ACP Salento e ACP Puglia-Basilicata. Prevalenza di mamme sieronegative per rosolia in Puglia. Quaderni acp, in pubblicazione.
38.Piano Nazionale Vaccini 2005-2007, pag.16-17.
39.Marchetti M, Colombo GL. Cost-effectiveness of universal pneumococcal vaccination for infants in Italy. Vaccine 2005; 23(37):4565-76.
40.Melegaro A, Edmunds WJ. Cost-effectiveness analysis of pneumococcal coniugate vaccination in England and Wales. Vaccine 2004; 22:4203-14.
41.Grandori L, Bonati M, Gangemi M. 8 passi di prevenzione a tutela della salute dei bambini. Medico e Bambino 2006; 25:643-6.
Articolo tratto integralmente da Medico e Bambino 2010; 29: 636-44 per gentile concessione dell'editore.