
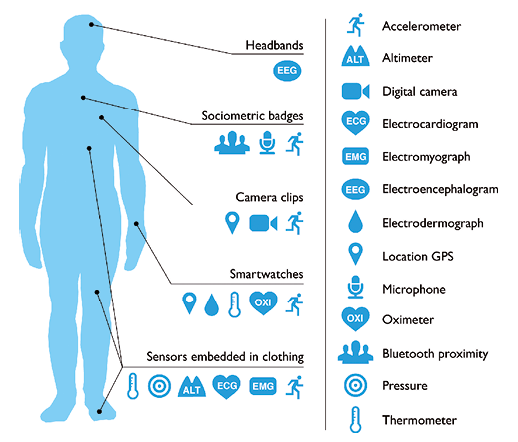
 Lo scenario al centro di questo contributo è riassunto nella Figura 1. Gli strumenti principali della medicina digitale, oltre alla tecnologia delle cartelle elettroniche, dei servizi online (consultazione di referti diagnostici o specialistici) e degli strumenti utilizzati per l’interazione con i pazienti (e-mail, sms, social network) sono i wearable device o dispositivi indossabili (DI), costituiti da uno o più biosensori, inseriti su capi di abbigliamento quali orologi (smartwatch), magliette, scarpe, pantaloni, cinture, fasce (smart clothing), occhiali (smart glasses), che possono rilevare e misurare diversi parametri biologici (frequenza cardiaca, respiratoria, saturazione di ossigeno, temperatura corporea, pressione arteriosa, glucosio, sudore, respiro, onde cerebrali) e fornire informazioni sullo stile di vita (attività fisica, sonno, alimentazione, calorie consumate).
Lo scenario al centro di questo contributo è riassunto nella Figura 1. Gli strumenti principali della medicina digitale, oltre alla tecnologia delle cartelle elettroniche, dei servizi online (consultazione di referti diagnostici o specialistici) e degli strumenti utilizzati per l’interazione con i pazienti (e-mail, sms, social network) sono i wearable device o dispositivi indossabili (DI), costituiti da uno o più biosensori, inseriti su capi di abbigliamento quali orologi (smartwatch), magliette, scarpe, pantaloni, cinture, fasce (smart clothing), occhiali (smart glasses), che possono rilevare e misurare diversi parametri biologici (frequenza cardiaca, respiratoria, saturazione di ossigeno, temperatura corporea, pressione arteriosa, glucosio, sudore, respiro, onde cerebrali) e fornire informazioni sullo stile di vita (attività fisica, sonno, alimentazione, calorie consumate). ha l’obiettivo di realizzare la smart medical home, caratterizzata dallo sviluppo di sensori a livello del pavimento e indossabili, telecamere, apparecchi a infrarossi, che possono valutare il rischio di caduta e in generale la validità della deambulazione, o riconoscere la caduta, con segnali di allerta per care givers o centri di riferimento collegati in remoto. Nella smart home PA, FC, peso corporeo, urine e feci potranno essere analizzate quando il paziente si siede sul water. Sono inoltre disponibili sensori, posti tra il materasso e le lenzuola, in grado di registrare automaticamente i dati relativi al sonno e inviarli mediante una connessione blue tooth ad un’app su smartphone o tablet. Il sensore riconosce quando il paziente si sdraia e avvia automaticamente il monitoraggio, raccogliendo e analizzando la durata e l’efficacia del sonno, la FC, la respirazione, il movimento, il russamento, la temperatura e l’umidità della stanza.
ha l’obiettivo di realizzare la smart medical home, caratterizzata dallo sviluppo di sensori a livello del pavimento e indossabili, telecamere, apparecchi a infrarossi, che possono valutare il rischio di caduta e in generale la validità della deambulazione, o riconoscere la caduta, con segnali di allerta per care givers o centri di riferimento collegati in remoto. Nella smart home PA, FC, peso corporeo, urine e feci potranno essere analizzate quando il paziente si siede sul water. Sono inoltre disponibili sensori, posti tra il materasso e le lenzuola, in grado di registrare automaticamente i dati relativi al sonno e inviarli mediante una connessione blue tooth ad un’app su smartphone o tablet. Il sensore riconosce quando il paziente si sdraia e avvia automaticamente il monitoraggio, raccogliendo e analizzando la durata e l’efficacia del sonno, la FC, la respirazione, il movimento, il russamento, la temperatura e l’umidità della stanza. ci in molti studi.
ci in molti studi.