
 are, aumento della densità della mammella e del dolore mammario ed è stato anche associato ad un aumentato rischio di cancro della mammella invasivo e di eventi tromboembolici 2,3.
are, aumento della densità della mammella e del dolore mammario ed è stato anche associato ad un aumentato rischio di cancro della mammella invasivo e di eventi tromboembolici 2,3. 149 donne trattate con la combinazione EC/progestinico.8 L’EMA ha tuttavia segnalato che 4 donne con ispessimento endometriale di almeno 4mm non sono state sottoposte a biopsia endometriale e altre 8 donne né a biopsia endometriale né ad ecografia transvaginale. La quantità di dati missing non è stata considerata inusuale per uno studio di queste dimensioni. Tuttavia alcuni membri del CHMP (Committee for Medicinal Products for Human Use) dell’EMA hanno segnalato che anche un numero veramente basso di casi addizionali di iperplasia avrebbe potuto cambiare l’esito dello studio da un successo ad un fallimento e pertanto considerano non certa l’efficacia della combinazione EC/bazedoxifene nel ridurre il rischio di carcinoma endometriale.2 Per quanto riguarda la densità minerale ossea (endpoint secondario) il gruppo trattato con EC/BZA 0,45mg/20mg ha mostrato un aumento della densità minerale ossea della colonna lombare e dell’anca in toto in misura significativamente maggiore rispetto al placebo, ma non rispetto agli altri trattamenti. L’aumento della densità minerale ossea della colonna lombare dopo 12 mesi è stato significativamente maggiore con la combinazione EC/progestinico rispetto a quella EC/bazedoxifene. L’aumento della densità minerale ossea dell’anca in toto è stata pressoché analogo con i due trattamenti.8
149 donne trattate con la combinazione EC/progestinico.8 L’EMA ha tuttavia segnalato che 4 donne con ispessimento endometriale di almeno 4mm non sono state sottoposte a biopsia endometriale e altre 8 donne né a biopsia endometriale né ad ecografia transvaginale. La quantità di dati missing non è stata considerata inusuale per uno studio di queste dimensioni. Tuttavia alcuni membri del CHMP (Committee for Medicinal Products for Human Use) dell’EMA hanno segnalato che anche un numero veramente basso di casi addizionali di iperplasia avrebbe potuto cambiare l’esito dello studio da un successo ad un fallimento e pertanto considerano non certa l’efficacia della combinazione EC/bazedoxifene nel ridurre il rischio di carcinoma endometriale.2 Per quanto riguarda la densità minerale ossea (endpoint secondario) il gruppo trattato con EC/BZA 0,45mg/20mg ha mostrato un aumento della densità minerale ossea della colonna lombare e dell’anca in toto in misura significativamente maggiore rispetto al placebo, ma non rispetto agli altri trattamenti. L’aumento della densità minerale ossea della colonna lombare dopo 12 mesi è stato significativamente maggiore con la combinazione EC/progestinico rispetto a quella EC/bazedoxifene. L’aumento della densità minerale ossea dell’anca in toto è stata pressoché analogo con i due trattamenti.8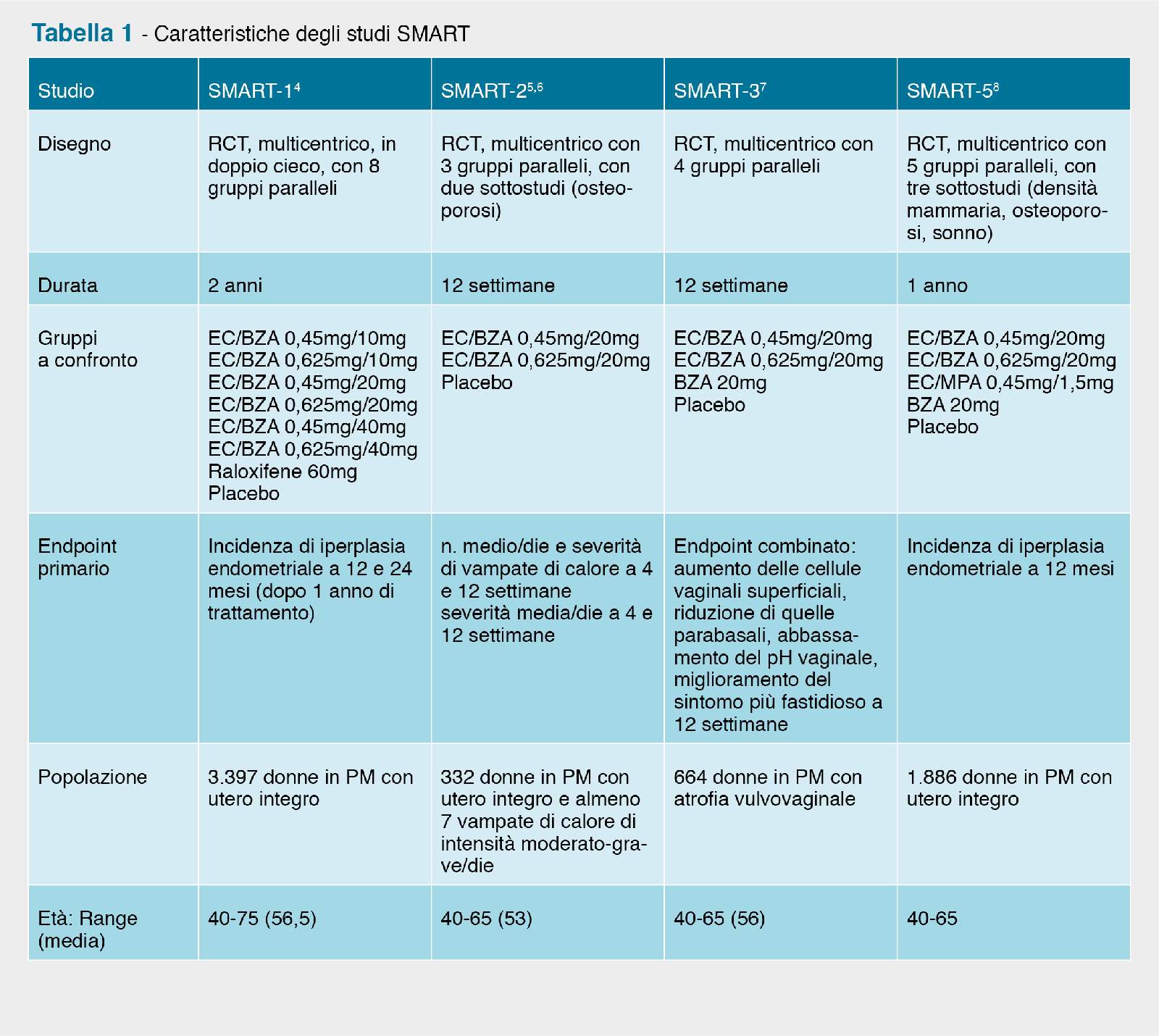
 bolizzato da enzimi uridin difosfato glucuronosiltransferasici (UGT) nel tratto intestinale e nel fegato; gli induttori dell’UGT (es. rifampicina) potrebbero ridurre le concentrazioni sieriche di bazedoxifene, con possibile aumento del rischio di iperplasia endometriale10.
bolizzato da enzimi uridin difosfato glucuronosiltransferasici (UGT) nel tratto intestinale e nel fegato; gli induttori dell’UGT (es. rifampicina) potrebbero ridurre le concentrazioni sieriche di bazedoxifene, con possibile aumento del rischio di iperplasia endometriale10.